本文由《Nature 自然科研》授權轉載,歡迎訪問關注。
科研人員希望通過維持大腦免疫系統正常工作來對抗失智和神經退行性疾病。
神經科學家Michael Heneka知道激進的想法需要令人信服的數據來證明。 2010年的時候,很少有同事贊同他所主張的觀點——大腦的免疫系統在失智症中起著至關重要的作用。因此,當他看到2010年5月的最新結果強有力地支持了他的理論時,除了興奮,他也感到十分緊張。
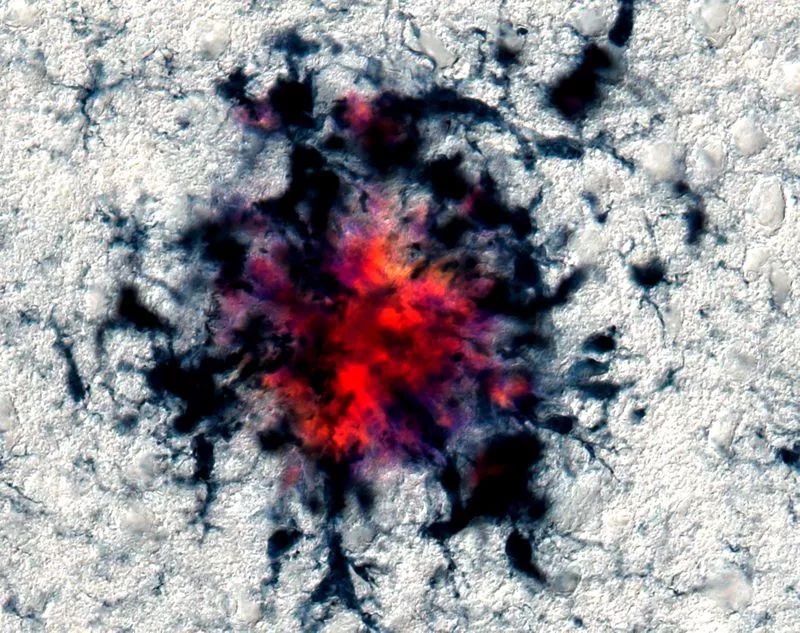
阿爾茨海默病小鼠模型中大腦斑塊附近的小膠質細胞團。
他和他的團隊敲除了易罹患阿爾茨海默病的一種品系小鼠的一個關鍵炎症基因。進行基因改造後的小鼠看起來非常健康。它們順利通過記憶測試,大腦內也幾乎沒有阿爾茨海默病標誌性的粘性蛋白斑塊。然而,Heneka知道他的同事可能認為這個結果太過理想,可信性存疑。
連Heneka自己也對實驗結果如此理想感到意外。他原先預計敲除這種被稱為Nlrp3的基因會對小鼠大腦產生一定保護作用,但並沒想到這種保護作用幾乎能夠預防失智。 「我認為實驗中一定有哪裡有問題。」在德國波恩神經退行性疾病中心工作的Heneka說。
他反覆對這些實驗結果進行分析,直至深夜,他不得不承認這些結果可能是真的。
在接下來的幾年裡,他證實了當年的實驗沒有出錯。他與同事一道複製並詳細闡述了當年的結果。此後大量研究更進一步證實了失智與大腦免疫系統之間的關係,並進一步闡明了其中涉及的部分細胞和信號通路。但是沒有人能完全講清兩者之間的關係——這種聯繫是動態多變的,隨著疾病的發展而不斷變化。
即便如此,這個想法也已經引起了醫藥投資者的興趣,他們從中看到了一個目前尚未完全開發的龐大市場:據估計目前全球有5000萬失智患者,世界衛生組織預計到2030年該數字將增加到8200萬。總部位於英國的失智協會 (Dementia Consortium) 是一個由慈善組織和藥物公司組成的聯合體,他們共計投入了450萬英鎊(570萬美元)支持八個藥物開發項目,其中四個都是以炎症反應為靶點的。
但我們還面臨著諸多挑戰。對於在疾病的不同階段是需要強化還是弱化免疫系統,科學家們還沒有達成一致意見。此外一些實際操作問題也阻礙著阿爾茨海默病臨床試驗,比如小鼠模型不甚完善,難以招募處於較早期的患者等,這些問題都可能阻礙這種新方法的應用。事實是迄今所有關於阿爾茨海默病的臨床試驗都失敗了,它就像一片烏雲籠罩在這個領域。
儘管如此,德國弗勞恩霍夫演算法與科學計算研究所的生物資訊學家Martin Hofmann-Apitius專門從事藥物研究,他提到研究人員已經提交了多項與炎症相關靶點有關的專利。 「很快我們就會看到一大波臨床試驗。」他預測道。
異常蛋白結塊和周邊組織腫脹
20世紀初,德國精神病學家 Alois Alzheimer是第一個描述失智癥狀和病理學特徵的人。他用顯微鏡觀察了一個認知逐漸衰退的女病人的大腦,他看到並整齊地畫出了病人大腦中的斑塊,現在我們已經知道斑塊中含有β澱粉樣蛋白和tau蛋白,這些斑塊是阿爾茨海默病的標誌性表現。
在對受累腦組織早期的描述中,阿爾茨海默還提到了小膠質細胞,這是大腦中的一種免疫細胞,棲息在神經元附近。「阿爾茨海默自己注意到小膠質細胞的存在,並根據觀察情況在神經元旁邊畫了大量此類細胞。」Heneka說。
儘管阿爾茨海默的草圖並沒有描述小膠質細胞和疾病之間更深的聯繫,但20世紀90年代中期,關於炎症和阿爾茨海默病之間聯繫的研究逐漸展開,Heneka想起了阿爾茨海默早期的描述。他注意到一些早期流行病學觀察的結果,這些觀察表明服用抗炎藥物(如治療類風濕性關節炎)的人群似乎比一般人群患阿爾茨海默病的風險更低。
還有報導說小膠質細胞主要聚集在斑塊和腦部變性區域周圍,且患者腦脊液內也能夠檢查到多種炎症分子,如細胞因子等,這都讓Heneka備受鼓舞。大多數科學家認為這反映了機體對組織損傷的被動反應,但Heneka卻認為炎症可能參與疾病的發病過程。
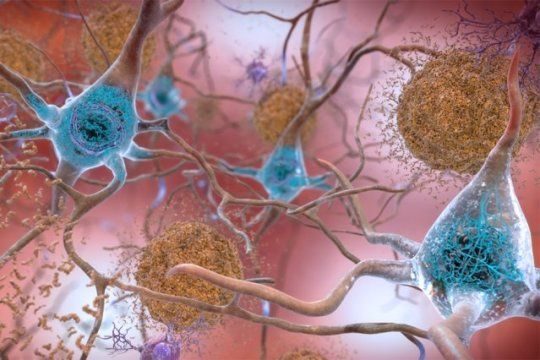
小膠質細胞目前被認為是炎症與神經退行性變之間的關鍵介質(見圖「幫助或阻礙」)。小膠質細胞主要有兩個功能。第一個功能是保護神經元和突觸,突觸就是神經元之間彼此交流的連接點。此外,小膠質細胞在大腦內遊走,尋找潛在威脅和問題。當它們檢測到感染性或其他異常分子如β澱粉樣蛋白、受損細胞碎片等時,這些小膠質細胞會被激活並發信號給其它同類細胞,一道清除這些異常分子。
某些小膠質蛋白會聚集成較大的複合體,稱為炎症小體(這些炎症小體的關鍵組成之一就是是Heneka所用的NLRP3蛋白)。炎症小體以活化免疫分子的形式產生並傳遞清除異常分子的信號。正常情況下異常分子被清除後,炎症小體就消失了,但在阿爾茨海默病患者中,這些炎症小體似乎會保持激活狀態,繼續產生炎症分子但不再履行正常的清除功能。

2013年,小膠質細胞開始進入阿爾茨海默病研究人員的視線。Heneka的論文顯示阻斷炎症能夠緩解小鼠的阿爾茨海默病病理學表現。就在差不多同時,《新英格蘭醫學雜誌》發表了兩項阿爾茨海默病相關基因變異的大型研究。這兩項研究都將發生遲髮型阿爾茨海默病的風險與一種名為TREM2的基因聯繫起來,而TREM2產生的蛋白就在小膠質細胞的細胞膜上。
這些研究同時引起了神經科學家和免疫學家的關注。神經免疫學這一跨學科領域就此萌芽。 「突然之間,巨大的機遇開啟了。」義大利米蘭大學的神經科學家 Michela Matteoli說,她現在在鄰近的Humanitas研究所的免疫部門開展神經科學項目。她發現那裡有缺乏特定免疫系統成分的各種小鼠模型,過去免疫學家從未想過用它們來研究大腦功能。 「這裡有很多我們需要的工具。」她說。
英雄還是惡棍
小膠質細胞既然在正常狀態下能夠維持大腦良好秩序,那麼在阿爾茨海默病中為何成為了一股「邪惡」力量呢?去年Heneka及其同事發表研究成果,提出了在他們的小鼠身上發生這種轉變的可能機制。他們發現活化的小膠質細胞所遺留的炎性殘餘物會形成小斑點,這些斑點會形成新的β澱粉樣蛋白斑塊,從而將疾病傳播到整個大腦。 「一場完美的風暴。」Heneka說, 「有毒的β澱粉樣蛋白誘發了炎症,而炎症又促進了更多有毒的β澱粉樣蛋白沉積。」
現在Heneka正與波恩大學的免疫學家Eicke Latz一起開發一種能阻止炎症小體形成的藥物。這不會影響小膠質細胞的正常功能,只是阻斷了它們招募其它同類細胞進行異常成分清除,從而控制了β澱粉樣蛋白-炎症風暴。
Latz 在2016年與他人在波士頓共同成立了初創公司IFM Therapeutic,去年被製藥公司Bristol Myers Squibb收購,目前已有一些阻止炎症小體形成的候選藥物,Latz和Heneka希望能在未來幾年開始臨床試驗。
與此同時,世界各地的神經免疫學家正試圖對小膠質細胞的生物學特徵進行進一步研究,以確定是否能通過其他途徑為阿爾茨海默病和其他神經退行性疾病設計免疫療法。其他一些科學家認為可以通過增強小膠質細胞的健康功能來更有效地清除毒性β澱粉樣蛋白,而不是單純地阻斷炎症風暴。
兩項小鼠和人體屍體解剖實驗發現,聚集在大腦斑塊周圍的小膠質細胞是一個非常特殊的亞群。這些小膠質細胞某些基因的表達水準與其他小膠質細胞不同,通過基因表達模式分析,研究人員發現了一個有趣的現象:這些小膠質細胞似乎會努力上調正常的「管家」功能以清除斑塊。其中有的基因會消除細胞活化通路中的「檢查點」,有的基因位於損傷識別或異常分子吞噬通路中,不論是哪一種情況,就基因表達模式來說,小膠質細胞都在不斷增強其「管家」功能以保護神經元。
以色列魏茨曼科學研究所的免疫遺傳學家Ido Amit表示,這些基因中部分基因突變已經被確定為人類阿爾茨海默病的風險因素。他此前主導了上述其中一項關於基因表達模式的研究項目。
Amit說,小膠質細胞的存在明顯是有原因的,因此可能可以被用來治療疾病。 「研究結果似乎告訴了我們一些有關於其生物學特徵的重要資訊。」他說。如果能夠幫助小膠質細胞更有效地發揮其正常功能,並避免過度活化,它們可能有助於避免疾病發生,而不是加劇疾病病程。
如果仍有人對小膠質細胞在失智發生中的作用存在疑問——它們究竟是英雄還是惡棍—— 那麼以下這些文章可以提供答案。不僅是腦部的異常分子,身體其他部位的炎症也能夠激活小膠質細胞。流行病學研究表明,生活中的感染負荷會增加晚年生活中認知障礙或失智的風險。
4月早些時候,德國神經退行性疾病中心的Jonas Neher和他的同事們發現,將脂多糖(LPS)注入小鼠腹腔誘發炎症後,小鼠腦部小膠質細胞中的基因表達也會出現持續變化——即便LPS本身並未進入小鼠大腦。低劑量的LPS注射會導致小鼠腦內β澱粉樣蛋白和斑塊的水準增加;而高劑量注射作用則相反。
小膠質細胞還可能參與其他神經退行性疾病,因為研究人員在肌萎縮側索硬化 (ALS) 和帕金森氏病模型中得到類似的發現。Matteoli和其他研究人員的研究表明,小膠質細胞甚至可能與更廣泛的腦部疾病有關係,如罕見的神經發育障礙Rett綜合征。
免受蛋白沉積-炎症反應風暴傷害
Amit現在正在與產業界合作夥伴討論如何增強小膠質細胞的「管家」功能。 「這樣能使我們在損傷超出控制時,恢復自然防禦力。」他說。
有些科研人員擔心在疾病晚期激活更多小膠質細胞可能加速疾病惡化。 「我們對這些細胞的生物學行為還不夠了解。」哈佛大學醫學院的神經免疫學家Oleg Butovsky說。他長官了上述另一項關於小膠質細胞基因表達的研究,並且正在開發生物標記物以便在疾病不同階段識別小膠質細胞。他表示小膠質細胞的功能應當是加強還是被抑製,或者是否應當在疾病進展的不同階段使用不同的策略,目前仍不明確。
此外,並不是所有的科學家都認為免疫系統在神經退行性疾病中的作用隻依賴小膠質細胞。美國哥倫比亞大學的神經學家Philip De Jager正在開發一種以小膠質細胞為靶點的阿爾茨海默病免疫療法,但他表示身體其他免疫系統的細胞,如T細胞,儘管在大腦中的數量非常少,但也有可能與疾病相關。
儘管這些發現具有極大的臨床轉化意義,但還面臨兩個挑戰:阿爾茨海默病研究中使用的小鼠模型並不能很好地模擬人體情況,但同時又很難招募到測試新療法的合適患者。
攜帶阿爾茨海默病易感基因突變的小鼠的確會出現失智的表現,但癥狀出現速度太快,讓科學家們難以確定治療時機。 「我們的模型疾病發展太快了。」聖路易斯華盛頓大學醫學院的Marco Colonna說。他在TREM2的生物學性質方面做了大量工作。「阿爾茨海默病研究領域已經充分認識到建立一個澱粉樣蛋白自然積累的模型的重要性了。」他補充道。
另一個挑戰在於識別處於疾病足夠早期的病人以給實驗性藥物起效的機會。阿爾茨海默病研究人員認為,許多早期的試驗失敗並不是因為他們的假說(即β澱粉樣蛋白和tau是阿爾茨海默病發病的關鍵)是錯誤的,而是因為治療時間太晚了。患者入組的時候往往斑塊堆積和神經元退行性變已達到了一定程度,疾病進程已不可逆。
Heneka說,這可能是為什麼萘普生或羅非昔布等抗炎藥物和此前一些候選治療方法一樣,並未使阿爾茨海默病患者獲益的原因之一。用於識別疾病初期階段的生物學標記物正在開發中,即使真的開發出來,這些測試也非常昂貴和繁瑣,涉及腦部掃描和脊椎穿刺,這些測試仍需在臨床場景中進一步驗證。
這些不確定因素並沒有打消科研人員的熱情。 「我們已經為此興奮了好幾年了。」De Jager說。神經科學家們似乎看到了與腫瘤免疫療法相似的情況,腫瘤免疫療法就是通過增強患者免疫系統以攻擊腫瘤細胞。 「一些傳統上認為與免疫無關的疾病似乎也存在潛在的免疫學機制。」De Jager補充道。
當Heneka回想起那出乎意料的小鼠實驗時,他表示他對免疫療法治療阿爾茨海默病持謹慎樂觀的態度。新的試驗需要克服以前試驗所遇到的問題。他說,沒有人希望看到這一方法由於錯誤的原因而失敗。他也一再表示從未見過一隻應患了阿爾茨海默病的小鼠能如此出色地通過了記憶測試。?
原文以Is 『friendly fire』 in the brain provoking Alzheimer』s disease? 為標題,發布在 2018 年 4 月 24 日的《自然》新聞特寫上。
版權聲明:
本文由施普林格·自然上海辦公室負責翻譯。中文內容僅供參考,一切內容以英文原版為準。歡迎轉發至朋友圈,如需轉載,請郵件 [email protected]。未經授權的翻譯是侵權行為,版權方將保留追究法律責任的權利。
? 2018 Macmillan Publishers Limited, part of Springer Nature. All Rights Reserved
本文由《Nature 自然科研》授權轉載,歡迎訪問關注。點擊「閱讀原文」獲取英文原文。