本文系生物谷原創編譯,歡迎分享,轉載須授權!
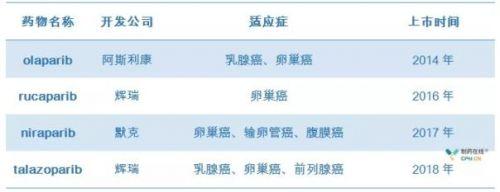
一種非常複雜的治療一些乳腺癌和卵巢癌的方法就是使用一類叫做PARP抑製劑的藥物。PARP抑製劑旨在利用讓發生某些突變的腫瘤特別致命的缺陷。然而,這種靶向癌症治療方法有時會失敗,科學家們迫切地想要知道其中的原因。
如今,在一項新的研究中,美國洛克菲勒大學的Titia de Lange教授及其團隊對這種耐藥性機制提供了新的認識,並且為抵抗這種耐藥性提供了新的希望。他們發現了由基因BRCA1發生的錯誤引發的一些癌症逃避旨在殺死它們的定製藥物的分子機制。這一發現也挑戰了之前針對這些PARP抑製劑成功地或未能給患者帶來益處的機制作出的猜測。相關研究結果於2018年7月18日在線發表在Nature期刊上,論文標題為「53BP1–RIF1–shieldin counteracts DSB resection through CST- and Polα-dependent fill-in」。
圖片來自Laboratory of Cell Biology and Genetics at The Rockefeller University。
他們的發現有助於解釋為什麼某些癌症會對PARP抑製劑作出反應,而其他癌症卻沒有---這種認識最終可能有助於改善對患者的治療。
缺陷和機會
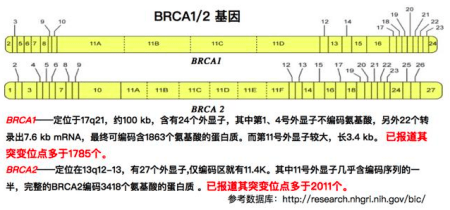
專家們預測今年將有大約288000例乳腺癌和卵巢癌新確診病例。這些癌症的很大一部分是由人類基因組中的兩個最臭名昭著的基因--- BRCA1和BRCA2---發生的有害錯誤引起的。 據估計,作為這項新研究主題的BRCA1突變會導致女性到80歲時患上乳腺癌的幾率大約為72%,患上卵巢癌的幾率為44%。
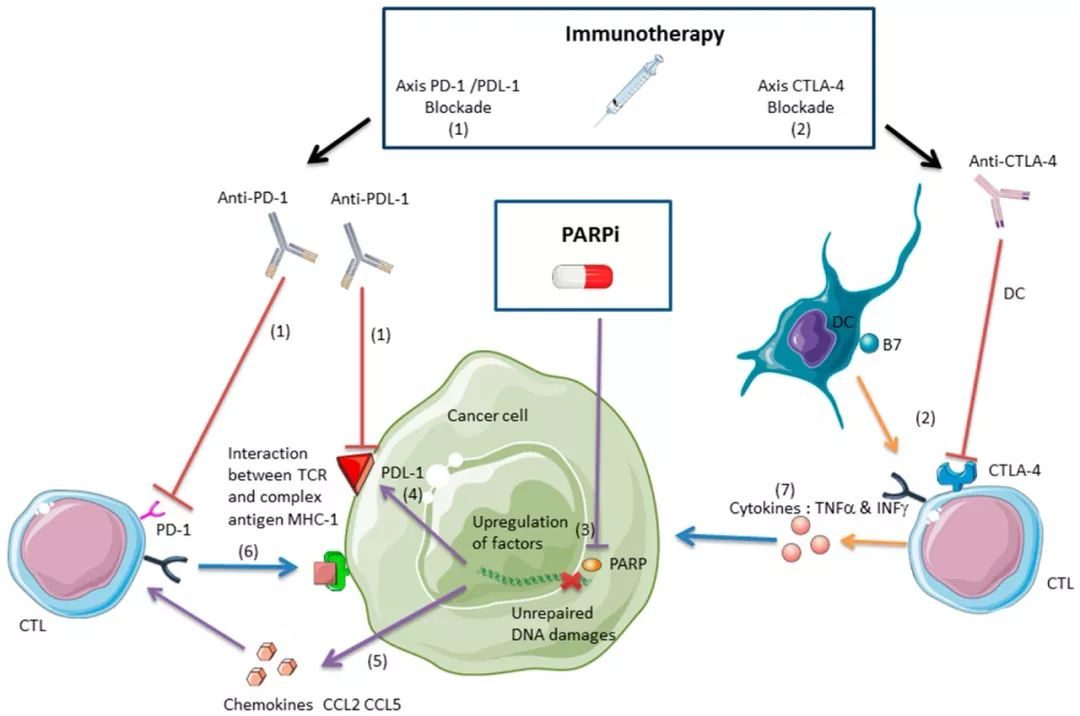
這兩個基因都是腫瘤抑製基因,這意味著它們在正常情形下有助於保持身體無癌症。它們編碼的蛋白在正確地修復沿著DNA分子的長度在某處發生的切割---一種被稱作雙鏈斷裂(double-strand break, DSB)的事件---中起著重要的作用,這是因為它起著切斷DNA螺旋的兩條鏈的作用。在缺乏BRCA基因的情形下,斷裂的DNA不能被正確地修復,從而產生能夠導致癌症的突變。
近年來,開發被稱作PARP抑製劑的新葯使得阻止這些遺傳缺陷轉化為癌症成為可能。這些藥物促使雙鏈斷裂形成;缺乏BRCA的腫瘤細胞因無法正確地修復這些斷裂而死亡。
然而,一些本應對PARP抑製劑敏感的腫瘤卻沒有作出反應。科學家們認為這種失敗的原因有很多,而de Lange團隊特別關注與BRCA1癌症耐藥性相關的罪魁禍首。
近十年來,科學家們已知道一種被稱作53BP1的蛋白的缺失使得缺乏BRCA1的細胞有可能克服它們的內在缺陷並正確地修復雙鏈斷裂。在PARP抑製劑治療期間或之後,一些腫瘤細胞在在發生導致53BP1丟失的突變後茁壯生長,這就能夠導致這種耐藥性產生。不過,人們仍不清除為何丟失這種蛋白會這些癌細胞帶來如此致命的優勢。
一種不同的機制
為了準備修複發生斷裂的DNA分子,首先需要切斷雙螺旋DNA的一條鏈。人們之前猜測53BP1會阻止這種切斷。按照這種思維,一旦53BP1丟失,那麼缺乏BRCA1的細胞就會突然獲得修復DNA斷裂的能力。
在實驗中,de Lange團隊證實53BP1發揮著不同的作用。這些研究人員發現53BP1反而有助於通過重寫從這些鬆散的DNA鏈中切下的DNA片段來抵消這種切斷過程。
在經過PARP抑製劑治療的BRCA1缺陷癌症中,53BP1的這種重寫功能導致錯誤的DNA修復和癌細胞死亡。然而,其中的一些癌細胞因失去53BP1而成功地逃避治療。de Lange團隊的這項研究解釋了僅這種變化如何讓它們存活下去。
de Lange實驗室研究生Zachary Mirman說,「總體而言,這種對53BP1功能及其在耐藥性中的作用的新認識為改進PARP抑製劑治療奠定了基礎。」這些研究人員說,這些改進可能包括開展篩查測試以便確定哪種腫瘤對PARP抑製劑作出產生最好的反應,或確定哪些其他的藥物應該或不應該與PARP抑製劑一起聯合使用。
原始出處:
Zachary Mirman, Francisca Lottersberger, Hiroyuki Takai et al. 53BP1–RIF1–shieldin counteracts DSB resection through CST- and Polα-dependent fill-in. Nature, Published online: 18 July 2018, doi:10.1038/s41586-018-0324-7.
閱讀原文,生物谷APP,圍觀更多精彩!