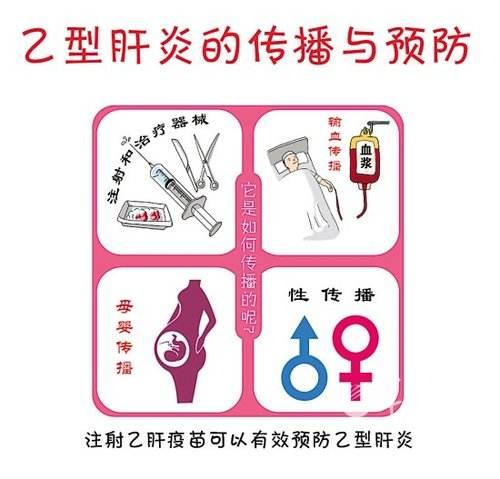
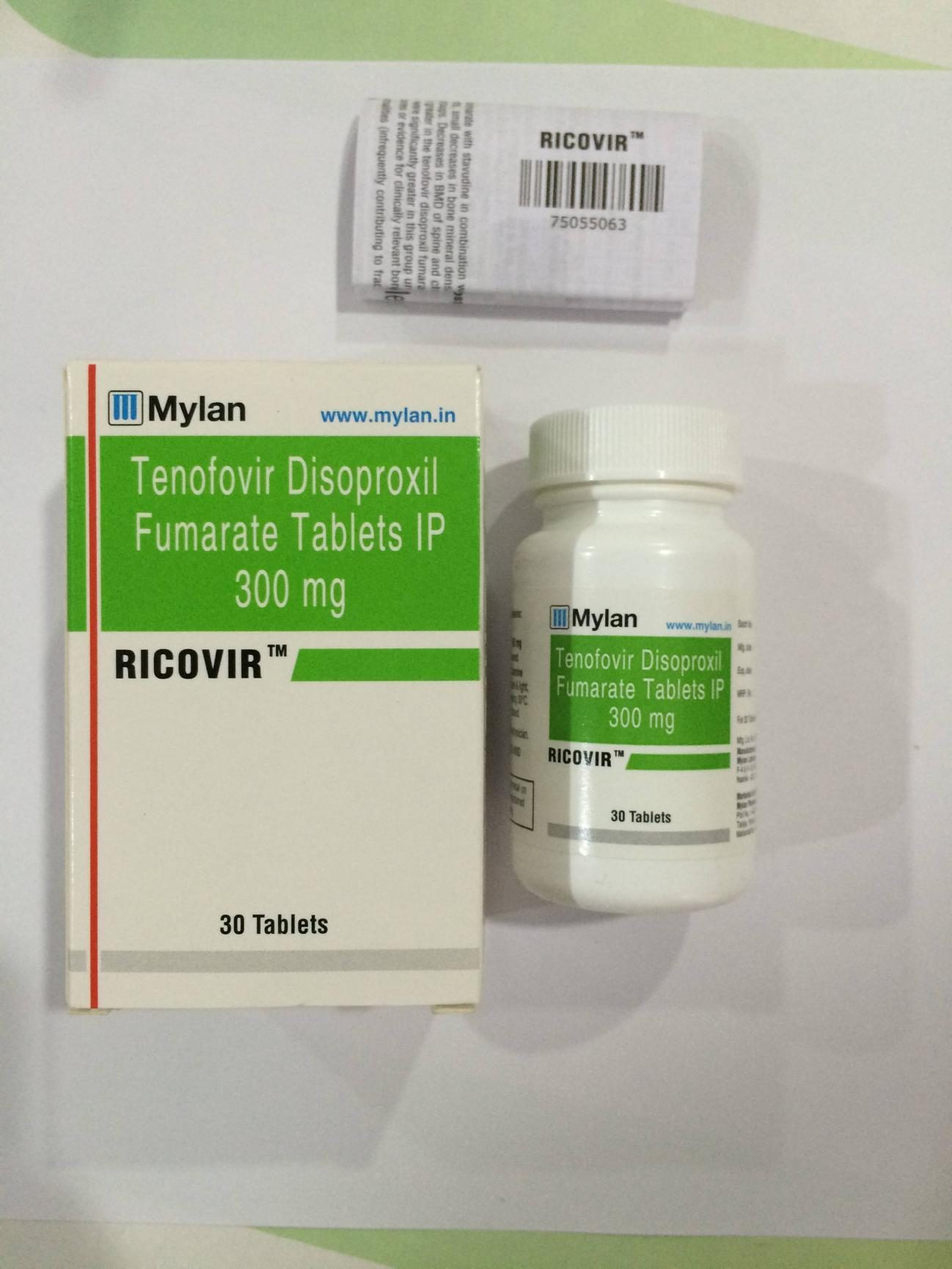
慢性B肝核苷酸類似物中,富馬酸替諾福韋二吡呋酯(TDF)和富馬酸替諾福韋艾拉酚胺(TAF)都是強效抑製B肝病毒複製藥物,且耐藥率低。一項韓國加圖立大學(Catholic University Of KOREA)主辦,韓國由TDF切換TAF關注療效和安全性研究。

B肝韓國多中心隊列研究,評價TDF切換艾拉酚胺,安全性有效性
越來越多科學研究發現,TAF的安全性高於TDF,特別是使用TDF在HIV、失代償性肝硬化(腹水)、糖尿病失控等高危人群中,存在較多腎髒安全性問題。然而,目前還沒有較多TDF-TAF切換療法慢性B肝患者(CHB)的有效性和安全性隊列數據。因此,本研究目的是評價TAF切換後的安全性和有效性。研究招募400名符合入選標準的受試者參與本次試驗。
這是一項前瞻性研究,試驗題目(英譯):韓國TDF-TAF轉換療法的療效和安全性研究。臨床試驗編號:NCT03559790,首次發布時間:2018年6月18日 最新發布時間:2019年1月30日 主辦部門:韓國加圖立大學(Catholic University Of KOREA)。實際研究開始日期:2018年7月18日,預計初步完成日期:2020年8月,預計研究完成日期:2021年8月。

研究人員將關注治療第96周時,完全病毒學反應;部分受試者血漿HBV-DNA水準低於116拷貝/mL;第96周時,血清肌酐升高作為腎髒安全性的衡量指標的發生率;血清肌酐升高(大於0.5mg/dL)與基線肌酐相比的發生率;第96周時,骨質疏松症和骨質疏松症發病率,作為骨安全性的衡量標準;從骨密度看骨量的減少和骨質疏松的發生率。
研究人員關注的次要指標有治療第48周、第96周時的生化反應;ALT正常化(男性<30 IU/L,女性<19 IU/L);治療第48周、第96周時的血清學反應;e抗原陽性慢性B肝患者的e抗原丟失率分析;e抗原陽性慢性B肝患者的血清轉化率研究;治療第48周、第96周時,引起的不良事件發生率;替諾福韋治療期間所有不良事件。

入選本試驗標準:18歲以上成人或老年人,不接受健康志願者,採用非概率抽樣方法,主要研究接受TDF-TAF轉換療法人群。在開始研究前,必須能夠理解並簽署書面知情同意書。成年男性和非懷孕、非哺乳期女性受試者,年齡18歲及以上,以篩查訪視日期為準。除非2歲以上的女性不孕不育測試需要在手術後進行。慢性B肝病毒感染書面證據(如B肝表面抗原陽性超過6個月);
初始治療曾使用TDF96周以上,包括慢性B肝類型:篩查時e抗原陽性、e抗體陰性、HBV-DNA大於或等於1x 10的5次方copies/ml、篩選血清ALT水準大於或等於2×ULN(80IU/L)且小於或等於10×ULN(按中心實驗室範圍)或篩查時e抗原陽性、e抗體陽性、篩查HBV-DNA大於或等於1x 10的4次方copies/ml;治療初期受試者定義為無抗病毒治療史或口服任何核苷或核苷酸類似物(包括拉米夫定或阿德福韋、克萊夫定、替比夫定、恩替卡韋)的抗病毒治療史在討論入組研究之前,提供者和患者決定從TDF切換到TAF在決定轉換治療後,在收到關於臨床研究目的和程序的指示後,簽署書面知情同意書必須願意並能夠遵守所有研究要求。

排除標準:孕婦、哺乳期婦女或認為自己可能希望在研究過程中懷孕的婦女。HCV、HIV共感染;肝細胞癌的證據(例如α-胎蛋白>50 ng/mL或通過最近的超聲或其他標準護理措施證明);篩查前5年內的惡性腫瘤,但通過手術切除治愈的特定癌症(基底細胞皮膚癌等)除外。正在評估可能的惡性腫瘤的受試者不合格;研究者判斷當前酒精或藥物濫用可能會影響受試者的依從性;目前正在接受細胞毒性藥物、腎毒性藥物或能夠改變腎髒排泄的藥物的治療;研究者認為會使受試者不適合本研究或無法遵守給藥要求的任何其他臨床狀況或之前的治療。返回搜狐,查看更多
責任編輯: