虎嗅注:這是虎嗅“新視野”系列採訪的第一篇文章,本篇主要關注醫藥投資、研發這個認知門檻極高的行業。主角是開發PD-1抑製劑並成功上市的君實生物,君實成立於2012年,主要關注新型生物醫藥的開發,包括腫瘤免疫療法、自身免疫性疾病及代謝疾病治療方面製藥研究。
出品 | 虎嗅原創組
作者 | 天使不投資人
編輯 | 李拓
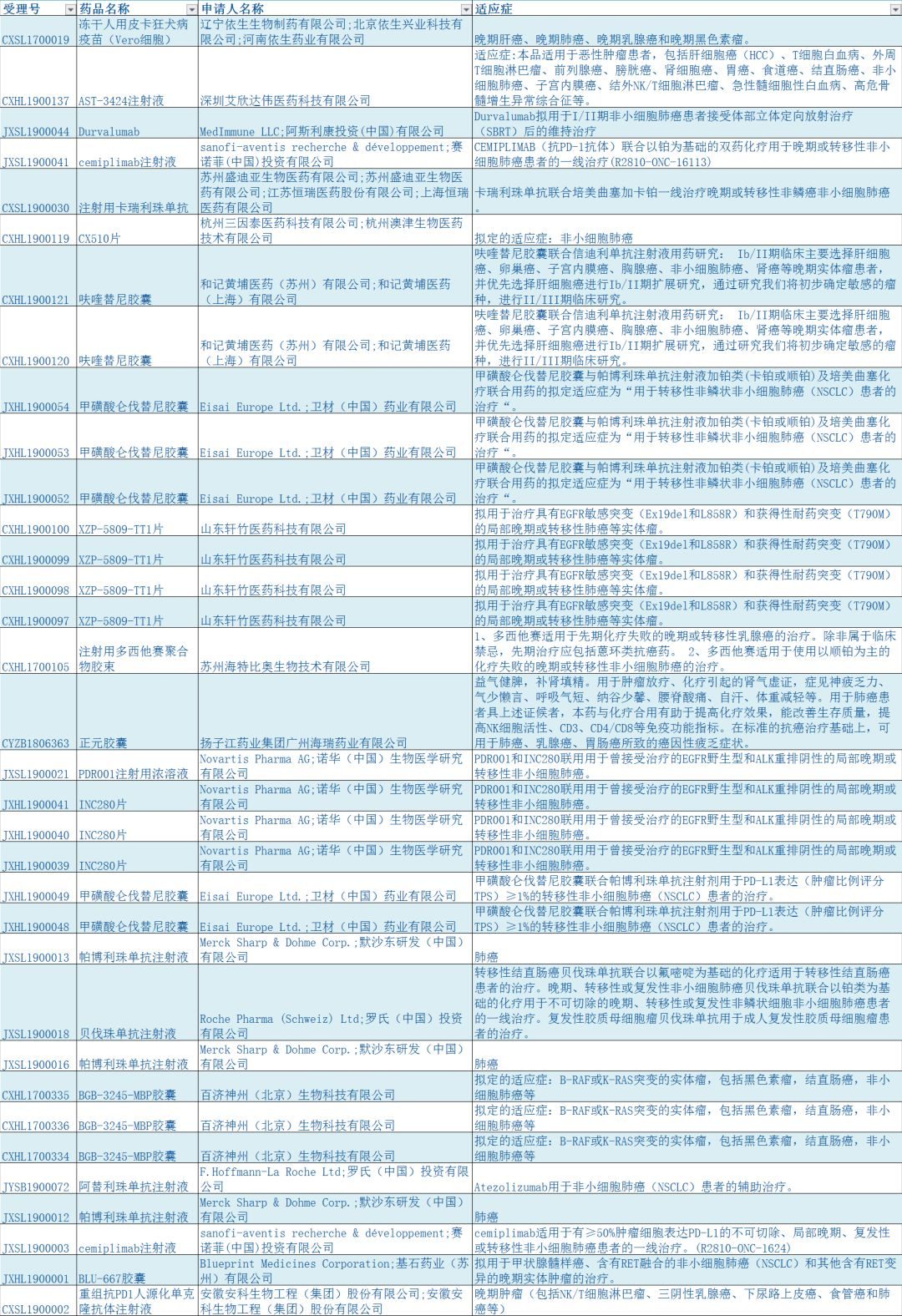
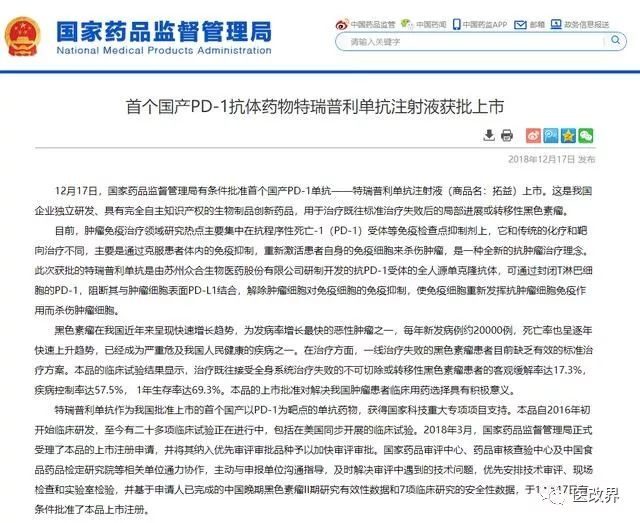
今年2月26日,抗癌藥“拓益”拿下了它在中國的第一張處方。與以往不同的是,“拓益”有諸多亮眼標簽:它是一款完全國研、國產的PD-1單抗生物創新藥。
事實上,中國製藥行業從2018年就開始了意義非凡的一年,不僅僅因為一部《藥神》的大火,也因為在現實世界中,中國藥企在廉價抗癌新藥領域終於有了一席之地。
這一年中,數家中國藥企向NMPA(即前CFDA,國家藥品監督管理局)提交了各自的PD-1抑製劑創新藥,其中首款獲批上市者是君實生物的“拓益”。與美國藥企百時美施貴寶(BMS)“O藥”和默沙東“K藥”相比,“拓益”價格十分低廉。這意味著在PD-1抑製劑這一創新藥領域,中國藥企與國際先進藥企展開了正面競爭。
雖然新藥給飽受折磨的中國癌症患者帶來福音,但關注PD-1的人群卻主要集中於科研工作者、主管部門、癌症患者家庭、藥企和少數垂直領域投資人。由於醫藥研發與投資認知門檻極高,多數普通人並不關注,非專業投資人也對醫藥研發投資“敬而遠之”,這種氣氛曾導致國內醫藥行業長期受關注不足、其中創新企業更常常被迫簞食瓢飲。
那麽,轉變始於何時?中國藥企又因何集中爆發?許多大臨床密集上線,背後的錢從哪裡來?百濟神州(9月24日)、信達(10月18日)、君實(12月24日)一年內先後上市港股,抓住機遇的投資人有何先見之明?
虎嗅與“拓益”開發者君實生物及其投資人之一正心谷聊了聊,並從正心谷創始人林利軍處得到一些答案。本文力求通過明白曉暢的語言,帶讀者一起了解這一輪“PD-1熱潮”是怎麽回事兒,為啥中國市場新醫藥研發起步晚、成果少,中國醫藥投資又是如何逐步演變並日漸成熟的。
與癌細胞捉迷藏
人類免疫系統中有一類T淋巴細胞(簡稱T細胞),其中有一項重要功能就是識別並殺死各種“非我族類”的病變細胞(比如癌細胞)。
T細胞之所以能識別癌細胞,是因為它能釋放免疫受體蛋白(比如PD-1,有個複雜拗口的中文名,叫“程序性死亡受體-1”),這種蛋白質就像一道安檢閘門,健康細胞才能安全通過,癌細胞不能。
通過這道門的關鍵就是要找到“鎖孔”並開鎖。PD-1上的“免疫檢測點”(immune checkpoint)就是那個鎖孔,正常細胞具備“表面蛋白質”這把“鑰匙”,通過與PD-1匹配以“通過安檢”,開鎖通行,而打不開鎖的癌細胞也能馬上被識別出來。通過“解鎖”機制,T細胞可以迅速且大規模識別和殺滅癌細胞。
PD-1這種精妙的識別機制,是在1992年由日本免疫學家本庶佑(Tasuku Honjo)發現的,他也因此在2018年獲得諾貝爾生理或醫學獎。
但問題是:如果這種識別機制真的有用, 那為什麽很多癌症還是會逃過T細胞的法眼並奪人性命?
很簡單,只要有鎖,就會有鑰匙。癌細胞沒有原配的鑰匙,但可以偽造一把——PD-L1配體就是這樣一把“假鑰匙”。搶佔了這道鎖之後,它會干擾T細胞對癌細胞的識別,抑製T細胞的增殖和激活,進而抑製免疫系統,導致T細胞凋亡,躲過一劫的癌細胞(這叫“免疫逃逸”),就可以繼續肆虐。
那麽,在分子層面治療癌症的思路就很明確了:人們製造了“PD-1抑製劑”,以阻止癌細胞配出的假鑰匙PD-L1與檢測點結合,保持T細胞的免疫功能持續激活,進而消滅癌細胞。

這本質是與癌細胞捉迷藏(嚴肅科普請移步知乎專欄“生物超循環” 的文章《
PD-1免疫療法的那些事兒(超全攻略)
》 )。
無論是從癌細胞的PD-L1下手開發PD-L1抑製劑(尚無代表產品),還是從T細胞的PD-1下手開發PD-1抑製劑(代表作O藥、K藥),都可以在一定程度上實現目的。事實上,以O藥和K藥為代表的PD-1抑製劑業已經過數年的市場驗證,效果非常不錯,而O藥和K藥去年也都在中國上市了。
其實因心腦血管疾病死亡的人數一直都比癌症多得多,但為什麽我們總是“談癌色變”?因為相比起來,癌症不僅得病痛苦,治療更痛苦。與傳統的化療、放療相比,PD-1治療副作用小,痛苦較輕,有效性還高——可以說,免疫療法的進步,正讓癌症變得“沒那麽嚇人”。
低價攻略
一個問題是:既然有了外國公司研製的PD-1抑製劑,我們為什麽還要費力研發新藥?一言以蔽之,因為“理論上廣譜抗癌”的PD-1抑製劑並不廣譜。
癌症病情複雜多變,在臨床治療實踐中,PD-1抑製劑都各自只針對少數癌症效果最好。比如“K藥”可瑞達(Keytruda)帕博利珠單抗注射液的第一個適應症是黑色素瘤,針對其它腫瘤的臨床還在逐步進行測試。
拓益和K藥相似,也是針對黑色素瘤的抑製劑。之所以不用帕博利珠,一方面是因為還沒過專利保護期——過期後默沙東以外藥廠生產的帕博利珠單抗就不是原創藥而是仿製藥了;另一方面也因為癌症本身的複雜性:比如美國人喜歡曬日光浴,黑色素瘤發病主因是暴曬,而中國人很少因暴曬而引發黑色素瘤。再加上族群本身的差異,無論國產還是進口,PD-1抑製劑都無法“一招鮮吃遍天”。
目前,針對中國的黑色素瘤患者特點,除了拓益,君實也在研發特瑞普利單抗-阿昔替尼聯合療法,提升拓益的治療效果。
既然不同PD-1單抗產品在藥理上不盡相同,那O藥和K藥在去年引進國內後,何以將價格降到如此之低?
一方面,不僅君實,國內其他藥企也紛紛在PD-1領域齊頭並進,君實的特瑞普利單抗、信達的信迪利單抗、恆瑞的卡瑞利珠單抗和百濟神州的替雷利珠單抗都已上市、送審或進入臨床二、三期;另一方面則在於,國產PD-1實在是太便宜了。
君實生物1月7日官方宣傳,拓益定價7200元/240mg(支),合30元/mg,按體重60kg計,年治療費用18.72萬元。而同樣適應症的K藥(可瑞達,帕博利珠單抗)價格為17918元/100mg(支),合179元/mg,年治療費用609212元。O藥(歐狄沃,納武利尤單抗)100ml裝的價格雖然只有K藥的一半,用量卻達到K藥的兩倍,核算下來藥費與K藥相差不大。
也就是說,拓益比主流的O藥、K藥便宜了一半不止。雖然O藥、K藥出於人道、推廣兩方面的需求紛紛公布了贈藥計劃(贈藥計劃一般為買4個療程送4個療程,也就是實際藥費只有一半),但君實也出於同樣目的和北京白求恩公益基金會公布了相似的贈藥計劃。贈藥之後,拓益的年藥費低至9萬元,就有點令O藥、K藥緊張了。
需要指出的是,K藥在中國大陸17918元/100ml的價格看上去並不便宜,但以人民幣核算,在香港的定價是26200元/100ml,美國更是高達33000元/100ml。如果沒有君實、信達、恆瑞、百濟神州這些國內藥企的努力,這可能嗎?
醫藥研投,愚公移山
科研本就是個“愚公移山”的活兒,醫藥產業的研發尤其如此。
人類理想中的“投入—產出”模型,追求的是“指哪打哪”,一分耕耘一分收獲;在投資領域,有時候多少可以實現“打哪指哪”(共享單車),收獲不夠,耕耘來湊,大力出奇跡。但科研這檔事兒,更像是氪金手遊裡的“保底”——抽100次我保底給你個SSR(性價比等於沒有),至於你平時出不出,就要看臉了。
科學工作者自己都沒底兒的事兒,投資人就更不會有底兒了。因此,國內的醫藥投資在很長一段時間內依賴政府設立的基金或產業園,民間投資起步較晚。實際上,君實生物的投資方之一正心谷,其創始人林利軍便是個罕有的醫藥投資“老江湖”。2010年左右,隨著國家醫保提高對仿製藥的重視,仿製藥企業一時成為投資熱點,林利軍創建的匯添富就是先行者之一。而下一撥醫藥投資熱潮,則要等到2015年了。
一個兩難的問題擺在投資者面前:如果你不懂醫藥,難以分析企業項目、團隊好壞,採用廣撒網、投早期、少跟投的投資策略,那麽預期回報可能不會很理想;如果你做了深刻研究,對醫藥“懂那麽些”,認準了少數優秀的項目和團隊,那麽你就要開始面對醫藥研發的一個關鍵問題:成本是個無底洞,跟投金額隨著項目深入水漲船高。
拿君實的例子來說。在產品研發的過程中,某種抑製劑針對某種病症三期臨床的“一個臨床”——實驗中一個病人在完整的治療及後續觀察期內的花費就高達50萬人民幣。而這樣的病人有多少“個”呢?答案是500個。也就是說,僅該產品針對某病狀三期臨床一項支出,理論上就高達2.5億人民幣。
實際操作中當然不會每“個”臨床都那麽貴,也有一些稍微降低支出的方法。但問題在於,這只是該抑製劑針對某種病症的臨床,還有其他病症呢?三期臨床不是憑空蹦出來的,還有一期和二期呢。
何況,藥品成功的概率就像那“抽100次才給保底”,任何新藥研發團隊,不論是來自恆瑞這種老牌大企業,還是創立沒幾年的新公司,都不可能將未來砸在一個單獨的產品上。
想將風險控制在一定範圍內,同時開展的研發管線都會有好幾條,比如我們可以看看君實同時在研的產品及針對不同病症開展的臨床數量:

其中,JS001便是已經上市的拓益,但我們可以看到該藥只有針對“黑色素瘤2L”一種病症的進度達到了NDA(新藥評審)階段(如今已過審)。上文提到的“特瑞普利單抗-阿昔替尼聯合療法”的進度也可在表中看到(第三行),隻進行到臨床一期,還有的是燒錢的時候……
而在整個研發中,只有突破NDA階段的產品才能給公司帶來收入——研發過程是頭貔貅,吃掉巨量的資金帶不來任何流水,基本隻進不出。JS001(拓益)上市了,意味著可以向所有這些患者開賣了麽?當然不能。首先患者不一定買得起,而國家買單(加入醫保)還需要額外流程,無論患者還是藥企都不能著急。
所以大多數新藥就算已經上市,短時間內能給公司帶來的收益都有限,而之後要走的燒錢路卻還很長。
而且,看準優秀的項目、團隊,不代表就不會“看走眼”。即便病症市場明確(有多少得這病的人,他們願意出多少錢,醫保有沒有覆蓋可能),科學理論扎實(世界範圍內的論文夠不夠多、質量如何,有沒有可借鑒的類似產品),研發方法可控(臨床好不好找,成本能否接受),團隊的幾位核心人員都是業界大牛、人品也妥妥的,他們就有很高概率成功嗎?
不是的。醫藥研發,尤其像君實這樣年頭不長(2012年創立)、家底不厚的小團隊,成功路上面臨的最大困難之一,是核心成員的四次“身份轉變”。
第一次身份轉變,是從理論科學到應用科學。
新藥開發,尤其對於新公司而非老藥企,是一群化學家、生物學家從零出發,他們此前的研究方法和專業藥企的研發團隊有所不同,要調整自己進入這個狀態,才算過了“第一關”。簡而言之,即便投資人找一個化學、生物學領域的大牛,他也不一定能一頭扎進製藥裡。
第二次身份轉變,是從“科學家”到“醫生”。
到了臨床階段,怎樣找到患者,怎樣勾搭醫院,怎樣和主治醫師展開明確、細膩的合作,怎樣準確地跟蹤、收集數據,和蹲實驗室階段就差別很大了。實際操作時,許多科研工作者乾脆就每天住在醫院。這是一個又苦又累的工作,更可怕的是很多科學家並不適應這種工作方式的劇變。
第三次身份轉變,是從“研發”到“生產”。
在實驗室裡能做出來的東西,在工廠裡不一定能做;即便能做,良品率也不一定可靠;即便可靠,生產成本也不一定能夠接受。可以類比羅永浩老師的錘子手機,上市前送給少數KOL,得到一片讚譽,量產後到消費者手裡就沒那麽驚豔了。手機企業尚且如此,製藥又怎麽容得馬虎?
第四次身份轉變,是從“技術專家”到“管理者”。
進入臨床和審批、上市階段後,企業的工作就不再局限於研發,而是要一面鋪開渠道準備銷售,一面擴大規模、降低成本、迎接競爭。在這一過程中,不僅要考慮的事情變多,管理團隊規模也從最開始三五人、十數人的典型“創業公司”變成上百人的大藥企。
這其中任何一步都挺凶險的——其實許多非醫藥領域的創業公司多少會遇到其中的一兩個難關,前車之鑒也不在少數了。
實際操作中,許多創業團隊止步於第三次轉變之前——在取得可靠的研究成果後,他們會選擇一直做個“to B”的小團隊,將研發數據賣給成熟的pharma(pharmaceutical company,製藥公司)。這樣雖然避免了一次次痛苦的轉型,也規避了今後可能的風險,但可想而知,也自然放棄了新藥可能帶來的巨大收益。
在電影《我不是藥神》口碑爆發期,藥企的收益規模已經有很多科普了,相信大家心裡都有底兒。讓人自覺放棄這種動輒數千萬、上億的利潤絕不容易,側面也反映了藥企從零到一的風險有多大。
即便在互聯網領域,許多讀者也有從研發到生產、從技術到管理的轉型經歷,這個過程痛苦嗎,結果令你滿意嗎?各位不妨換位思考,來感受一下這些研發者有多辛苦,或許也就能理解格列衛為何死活不願意降價了。
中國創新藥還有戲嗎?
雖然藥企面對種種困難,且中國相對發達國家科研氛圍並不太好,但客觀來說中國也有自己的獨特優勢。後續將要提到的幾個偶然性的推動政策,都只是釋放了中國市場本身的潛力,並非根本原因。
中國最大的優勢首先是市場龐大。作為剛需,在中國賣藥的利潤前景非常優秀。上文曾提到過,新藥研發要考慮具體的病症,也要考慮不同族群的臨床反應。如果僅針對某一地區開發新藥,中國無疑是個很不錯的選擇。
另外,也是由於人口龐大,在中國找臨床也相對容易。這一方面使臨床成本不太驚人(雖然也很高了),一方面意味著許多在歐美會被臨床樣本量卡住的項目,在中國可以飛速推進,這就注定中國的新藥研發,在其他因素到位時,進展可以很快。
另一方面,中國並不太缺少相關人才。由於公派出國的支持,20世紀八九十年代中國出現了大批奔赴發達國家接受教育的留學生,在當時,一件十分尷尬的事便是他們中許多人留在了歐美工作,並逐漸升任各企業管理層。
而之後,一方面由於中國經濟相對迅速的增長,一方面由於華人在海外普遍遭遇的“玻璃天花板”,為了尋求更高的收益,這批積累了大量經驗、也學會了外企先進、標準“玩法”的高級人才開始逐漸回國。在生物醫藥領域,最早回國的人才普遍做起了外包服務,大名鼎鼎的藥明康德便誕生於這個時期的開端。
隨著中國創業環境改善、市場飛速增長,人才回流也加快了步伐。如今,美中醫藥開發協會(SAPA)中國分會的6000餘名會員中,有近2000人已經回到工作或創業。這一出國學習-回國代工-自主創新的循環,在其它行業曾經無數次出現,醫藥行業概莫能外。
但是,即便有如此大環境,中國起步還是太晚了些。
上文曾提到中國的兩次(也是僅有的兩次)醫藥投資熱潮,一撥是2010年起對仿製藥企業的投資,一撥則是2015年起對創新藥企業的投資,主要都基於醫保政策重心的調整:從中草藥、中成藥到仿製藥,從仿製藥到創新藥。創新藥是我們最關注的,也是這一撥PD-1爆發的基礎。
除了醫保,還有另一個原因,就是NMPA(還記得CFDA嗎)審批新藥的速度大大加快。從前,中國藥品審批速度慢飽受詬病,原因一方面在於缺乏經驗、管理混亂,一方面也由於理念落後,追求以大量前置審批代替日後監管(國內醫藥監管問題就不多嘴了),結果審批漫長不說,過審的藥也沒少出事兒。
在減少前置審批、增強後續監管後,新藥審批速度明顯加快(當然,NMPA的審批工作人員也已經從100多人擴展到600多人)。從業者稱,對於受重視的仿製藥、創新藥,審批速度從曾經的動輒一、兩年變為如今的三個月到半年,讓企業減少了不少風險——上段曾提到藥企的研發成本多麽驚人,那麽自然可以想象早一年賣、晚一年賣區別有多大。實際上,被審批耗死的企業從來不在少數。
可以說,這幾年創業公司和老牌藥企紛紛投身新藥研發,最直接的原因就是審批流程優化。這一方面減少了藥企經營者的風險負擔,一方面也縮短了藥企投資人的回報周期,因而引發了很大一波資金湧入醫藥研發領域,造就了2018年的“PD-1上市大爆發”。
提到上市,還不得不感謝“新三板+H股”的兩地掛牌機制。2018年4月21日,全國中小企業股份轉讓系統與港交所簽署了合作諒解備忘錄,新三板企業不必摘牌就可登錄港股——要不君實上市可沒那麽快。
但是,為什麽是PD-1呢?或者說,投資人是怎麽認準了“免疫療法”“生物藥”這些概念,從而投出了如此多成功的PD-1抑製劑呢?這方面,正心谷創始人林利軍做了一段很精彩的闡釋(以下為歸納):
免疫療法的成功有跡可循。我們觀察哪些研究在發達國家,尤其美國取得了重大突破,就可以預測接下來幾年醫藥研發的趨勢。前些年,隨著免疫學、基因學的一系列突破,免疫療法從猜想逐步進入應用,O藥、K藥的成功更是例證,我們就不難鎖定免疫療法這條賽道了。
鎖定賽道後,就是垂直領域投資的工作,深度研究,發掘哪些藥物的市場潛力大。這樣我們就很快發現PD-1,也能觀察到君實生物在黑色素瘤方面的進展,再去考察他們的團隊,就不難決定是否要投。
雖然PD-1面臨的競爭比較激烈,但競爭也是分階段的。生物藥有一個好處,就是研發、生產技術含量高,仿製難度很大。研發時雖然對手多,但一旦上市,專利保護期過後不像化學藥那樣會飛速面臨專利斷崖。這樣收益期就還是比較長的,利潤也比較有保障。
簡單來說,醫藥領域也存在類似互聯網領域的“C2C”(copy to China),只不過不是山寨,而是依靠先進的研究成果、理論基礎,模仿歐美的製藥方向,做出適合中國人的創新藥。而PD-1在中國的階段性成功,是市場、政策及生物藥本身特點綜合作用的結果。
即便換一個概念,只要能夠遵循“科學基礎是保障、深度研究是本分、未來市場可期待”的原則,即便不像林利軍這樣少數醫藥“老江湖”,也並非不可能找到下一個機會。
對投資機構和投資人而言,更關鍵的或許是幫助研發團隊實現“身份轉變”中的第三、四次,不要讓新藥折在技術以外的地方。在正心谷投資君實的過程中,君實就一度十分猶豫是要自建藥廠、在國內實現規模生產,還是踏實搞研發、將成果賣給pharma。正心谷在整個決策過程中,也幫助幾個科學家邁出了了關鍵一步,這才有了今天上市的君實,也有了逼著O藥、K藥大降價的拓益。
更可貴的是,中國的創新藥研發、生產鏈條,已經從曾經的“全靠政府、政策”,轉變成“政府(園區)投早期、私募投中期、上市可持續”的健康鏈條;而對於那些難以邁出“第三次轉型”的團隊,國內pharma收購研究成果的環境也日趨成熟,整個產業都在變得豐滿、立體起來。
如今,幾家因PD-1而上市的中國藥企並未在資本市場受到持續追捧,股價也起起伏伏。2015~2018年的創新藥、生物藥投資熱,還會持續多久?下一個機會又在哪兒?
對這個如今已經“轉起來”的國內新藥產業,我們大可保有信心。新藥研發利國利民,對“模式經濟”感到疲倦的資本,若能抽一部分精力投身其中,想必不僅能收獲真金白銀,也會收獲遠超互聯網投資的成績和榮譽,以及病患的真誠感謝。
——以下是虎嗅“新視野”系列報導的三言兩語——
在過去幾年中,我們對商業模式的關注和探討已經夠多,而一旦寒冬來臨,沒有核心技術支撐的產業模式將最先倒下。2019年,我們推出“新視野”系列報導,一起關注有硬核科技支撐的公司與產業,按虎嗅的標準,它們至少應該具備“三高兩長”的特徵(高技術門檻、高投入與高風險,超長回報周期、超長社會效益)。
理解這些高科技原理本就有相當的門檻,將之傳遞給普羅大眾則更是個技巧活兒,但如果你關注有價值的科技報導,關注真正的創新者,關注這個世界的未來,那你或許不應該錯過未來的“新視野”。
最後,如果您對喜歡本系列報導,並有看好的項目,歡迎在評論區推薦或自薦。