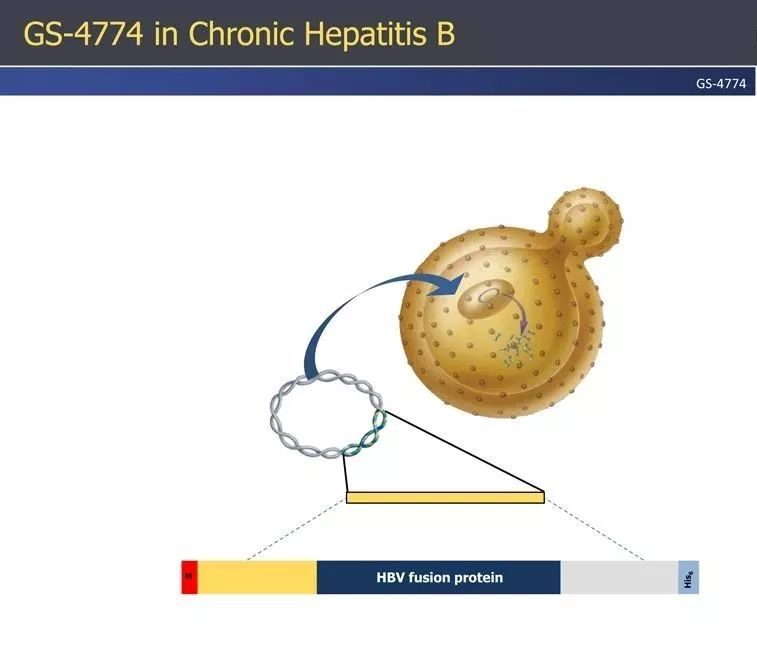
生物製藥疫苗公司(VBI Vaccines)與騰盛博藥(Brii Biosciences)合作研發的治療性B肝疫苗BRII-179 (VBI-2601) ,在2021年歐洲肝髒大會上宣布了完整的Ib/IIa期研究數據。

B肝在研新藥VBI-2601,Ib/IIa期完整數據,支持後續聯合藥物評估
研究人員介紹,若可以實現功能性治愈慢性HBV感染,則無需患者終身治療,要想實現功能性治愈需要恢復患者受損的HBV特異性T細胞和B細胞免疫。基於主要結構(核心和S)和非結構蛋白(聚合酶)的治療性疫苗已經在慢性B肝患者中進行了測試,但顯示出很少的免疫原性。
BRII-179,也稱為VBI-2601,是一種基於病毒樣顆粒的治療性B肝疫苗,使用與Sci-B-Vac®(一種預防性疫苗)相同的製造工藝在CHO細胞中生產。BRII-179是基於三種HBV包膜蛋白(Pre-S1、Pre-S2 和 S)的新配方和更高劑量,其Ib/IIa期研究,主要在慢性B肝患者中評估了BRII-179與α干擾素(IFN-α)聯合作為輔助佐劑的安全性、免疫原性和早期抗病毒活性。

這項隨機、開放標簽、對照的Ib/IIa期研究包括兩個劑量水準,分別是20微克BRII-179(第 1 部分;n=25)和40微克BRII-179(第 2 部分,n=24)。使用核苷(酸)類似物(Nrtl)治療下實現病毒抑製的非肝硬化慢性B肝(CHB)患者,這部分CHB患者在第1部分以1:2:2的比例隨機分為3個隊列,在第2部分中以1:1的比例隨機分到2個隊列,接受為期4個月的肌肉注射BRII-179或聯合使用3 MIU IFN-α。
監測抗體和細胞對B肝表面抗原的反應,以及B肝表面抗原的演變情況。研究結果表明,通過肌內注射給藥BRII-179(20 微克和40 微克)的兩種劑量水準,在所有隊列中均表現出良好的安全性和耐受性,無嚴重不良事件發生。

在所有治療組中, BRII-179可以誘導超過30%的患者抗HBs抗體反應,然而,僅在接受BRII-179+IFN-α的聯合給藥患者中,觀察到中度的抗 PreS1或抗 PreS2 抗體反應。BRII-179還能夠恢復或增強了大多數接受治療患者產生S-、Pre-S1-、Pre-S2 特異性 IFN-γ的T細胞。總體而言,在4劑BRII-179治療後,未觀察到B肝表面抗原水準下降或僅有極小下降。

小番健康結語:Ib/IIa期研究結論是,在核苷類逆轉錄酶抑製劑治療下的慢性B肝患者中,聯合或不聯合輔助佐劑IFN-α,BRII-179均表現出良好安全性和耐受性特徵。BRII-179含有S、Pre-S1和Pre-S2抗原的有限劑量,可以在慢性B肝患者中誘導B細胞和T細胞反應(上圖:來源EASL2021大會上,本研究人員提供)。
在本研究期間,所恢復的HBV免疫反應沒有能改變B肝表面抗原的水準。這項關於治療性B肝疫苗BRII-179 (VBI-2601) 的Ib/IIa期完整研究數據,支持將BRII-179作為一種免疫調節劑與其他治療方式聯合使用,以進一步臨床評估其實現功能性治愈目標的可行性(PO-2575)。
總體上看,這種在研治療性B肝疫苗BRII-179 (VBI-2601) Ib/IIa期結果還是比較積極的,雖然,在4劑後沒有使表面抗原下降或僅有微小下降,但其無論在單藥或聯用α干擾素治療後,均表現出良好安全性和耐受性,沒有見到安全性問題。在將來可能作為一種新型免疫調節劑聯用其他藥物進一步評估。返回搜狐,查看更多
責任編輯: