不想錯過界哥的推送?


第9期肝膽胰腫瘤資訊~
本期提要
晚期胰腺癌:吉西他濱、白蛋白紫杉醇羥氯喹未改善生存;
門靜脈癌栓(PVTT)評分用於肝切除決策:來自我國的多中心數據;
肝細胞癌(HCC)免疫檢查點抑製劑的治療、研究現狀。
01
晚期胰腺癌:吉西他濱、白蛋白紫杉醇加用羥氯喹未改善生存
來自賓夕法尼亞大學及約翰霍普金斯大學的研究者發現,羥氯喹聯合吉西他濱、白蛋白結合型紫杉醇(HCQ+GA)治療晚期胰腺癌,與單純GA相比,儘管沒能改善12個月時的總生存(OS)率,但聯合組患者總緩解率(ORR)的改善可能表明HCQ在某些局部進展患者可以提高切除率。研究發表在JAMA Oncology。
自噬是一種化療耐葯機制,羥氯喹(HCQ)作為一種自噬抑製劑,在I期臨床試驗中已證實具有良好的藥物耐受。研究者通過II期臨床試驗,對比HCQ+GA與單純GA在治療晚期胰腺癌中的生存獲益與藥物毒副作用。
研究納入112名未經治療的晚期胰腺癌患者,隨機分為HCQ+GA組(n=55)與GA組,接受常規劑量的GA化療(n=57),聯合組加用口服HCQ 600mg Bid。
研究結果顯示,HCQ+GA組12個月OS率為41%,GA組為49%,組間無顯著差異(p= 0.44)。HCQ+GA組中位無進展生存(PFS)期為5.7個月,GA組為6.4個月,組間無顯著差異(p =0.25)。HCQ+GA組中位OS為11.1個月,GA組為12.1個月,組間無顯著差異(p= 0.53)(圖1)。


圖1.HCQ+GA與GA生存曲線對比
儘管兩組之間無顯著生存差異,但HCQ+GA組ORR為38.2%,顯著高於GA組的21.1%(p=0.047),如表1。
表1.治療組緩解率


與此同時,與GA組相比,HCQ+GA組3/4級中性粒細胞減少(42.6% vs 22.6%,p=0.03)以及貧血(3.7% vs 17.0%,p=0.03)更為常見。
作者解釋說,添加HCQ阻斷自噬並沒有改善12個月時總生存率。因此,不支持在現階段缺乏有效生物標誌物的情況下常規使用HCQ+GA治療晚期胰腺癌。然而,HCQ+GA組ORR的改善可能表明HCQ在局部進展胰腺癌中的潛在作用——提高腫瘤切除率。
02
近期上海東方肝膽外科醫院程樹群教授團隊聯合中山大學腫瘤防治中心、廣西大學附屬腫瘤醫院、華西醫院通過回顧性分析建立並驗證了一個評分系統,用於合併門靜脈癌栓(PVTT)的HCC手術後的生存預測,該評分可作為其他HCC分期系統的補充。研究發表在Hepatology。
HCC合併PVTT是預後不佳的重要標誌,指南僅建議採用索拉非尼治療,但近期研究顯示對於癌栓僅累及門靜脈一級分支及以上的患者手術切除可獲得更好的預後。作者就如何更加準確預測這部分患者手術後生存期。
根據納入及排除標準(HCC合併PVTT僅累及門靜脈一級分支及以上,R0切除,Child-Pugh≤7分,未行其他初始治療,無肉眼膽道、靜脈癌栓及肝外轉移),研究共納入5個隊列:
training組:來自東方肝膽432例回顧性隊列;
內部驗證組:東方肝膽285例前瞻性隊列;
外部驗證1組:中山286例回顧隊列;
外部驗證2組:廣西腫瘤189例回顧隊列;
外部驗證3組:華西135例回顧隊列。
5組隊列中,大多數患者為男性,腫瘤較大(>5 cm), HBV是HCC最常見的病因。圍術期30天和90天的死亡率0%-1.5%以及4.9%-7.7%。
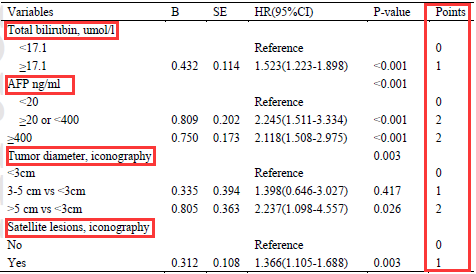
研究者在training組中,通過多因素分析發現總膽紅素、甲胎蛋白(AFP)、腫物最大徑、影像學子灶是OS的獨立危險因素,並依此建立評分如表2。
表2.東方肝膽PVTT評分

同時作者在training組中發現評分≤3者中位OS為19.9個月,顯著高於>3分患者的8.9個月,p<0.001。遂以3分為閾值在驗證組中進行對比,得到同樣類似的結果,如圖2。


圖2.PVTT評分在4個驗證組中的生存分析
後作者將ALBI、CUPI、CLIP、Child-Pugh、JIS、Meld 評分系統分別用於以上4組,均難以達到該評分的效果。而研究者進一步通過採用隨時間變化的ROC曲線面積分析發現,該模型的AUC在驗證組中非常穩定,診斷能力高於其他分期方法。
作者認為,該評分可作為國際上常用的HCC分期和評分系統的補充,用於選擇可從手術治療中獲益的HCC患者亞組。
03
HCC免疫檢查點抑製劑的治療、研究現狀
免疫檢查點抑製劑(ICI)在晚期HCC中的應用效果已被證實,新藥物的臨床發展正在進入一個快速時代,來自倫敦帝國理工學院哈默史密斯醫院腫瘤外科的研究人員為我們總結了不同ICI的研究進展以及不同分期背景下ICI的應用。文章發表在Hepatology。
■細胞毒性T淋巴細胞相關蛋白(CTLA-4)
雖然CTLA-4的表達在HCC中不能預測預後,但它在調節T細胞(T-regs)和活化的細胞毒性T淋巴細胞(CTLs)中的廣泛存在均體現出其作為治療靶點的臨床價值。破壞CTLA-4/CD80-CD86之間的相互作用可以通過增強T細胞效應反應導致腫瘤排斥。
Ipilimumab與Tremelimumab是目前正在HCC臨床試驗中進行兩個的CTLA-4單克隆抗體。在一個丙型肝炎病毒(HCV)相關HCC的小型II期試驗中,Tremelimumab的ORR為17.6%,中位至疾病進展時間(TTP) 為6.5個月。
儘管CTLA-4抑製劑毒副作用大於抗PD-1治療,但其聯合應用的價值越來越高。
目前Ipilimumab與Tremelimumab正在分別與納武利尤單抗(Nivolumab)、Durvalumab進行聯用試驗(NCT01658878、NCT02519348)。
■ 程序性細胞死亡蛋白-1 (PD-1)及其配體(PD-L1/PD-L2)
PD-L1或PD-L2與T細胞表面PD-1結合可抑製T細胞活化。PD-L1在HCC中高表達,同時包繞抗原呈遞細胞可達45%-100%。PD-L1在不同HCC分期中的表達水準不同,影響OS與無病生存(DFS)。
帕博利珠單抗(Pembrolizumab)和納武利尤單抗是高效和高選擇性的PD-1單克隆抗體,而Atezolizumab、Avelumab和Durvalumab則是靶向PD-L1抗體。
帕博利珠單抗基於Checkmate-040試驗被美國食品藥品監督管理局(FDA)批準應用於晚期HCC。ORR為20%,1年的OS率為62%。同樣,索拉非尼失敗後帕博利珠單抗二線治療的初步結果顯示,ORR為16.3%,6個月OS率為77.9%。但其治療的副作用不能忽視,如表3。
表3.目前正在進行的ICI臨床試驗




■ 免疫治療在HCC治療中的定位
新輔助ICI治療:肝癌的新輔助治療仍然是一個挑戰,特別是目前仍然缺乏能夠顯著降期的全身藥物。
ICI輔助治療:肝癌的輔助ICI治療在治療時間和藥物選擇方面都缺乏明確的指導。
ICI與局部治療(LRT)的結合:肝動脈化療栓塞術(TACE)在激活低氧反應、促進血管內皮生長因子(VEGF)和其他促血管生成細胞因子釋放方面發揮作用。有證據表明PD-L1轉錄受低氧誘導因子(HIF-1α)調節,這也為TACE與PD-1/PD-L1抑製劑聯用奠定了理論基礎。目前正在進行的研究包括:帕博利珠單抗聯合TACE治療中晚期HCC試驗(NCT03397654)、納武利尤單抗聯合藥物洗脫微球(DEB)-TACE的研究(NCT03143270)。
ICI用於晚期HCC治療:系統性治療在晚期HCC中發揮的作用相對較小,中位OS很難超過1年,晚期HCC的一線治療方案正在從索拉非尼擴大到侖伐替尼(Lenvatinib),二線治療方包括瑞戈非尼(Regorafenib)和卡博替尼(Cabozantinib)。而隨著單葯免疫治療逐漸在肝癌顯示出疾病控制作用的證據,聯合治療策略的理論證據越發充足。
抗CCR4抗體Mogamulizumab與納武利尤單抗的聯合應用,在T細胞淋巴瘤中顯示出良好效果,目前正在進行用於HCC的I/II試驗(NCT02705105)。
TGF-β抑製劑Galunisertib與納武利尤單抗用於治療難治性肝癌(NCT02423343)的研究正在進行中。
IDO抑製劑Epacadostat與帕博利珠單抗聯合應用於包括HCC在內的實體腫瘤的研究(NCT02178722)正在進行。
作者同時也強調,僅在HCC中,截至2018年3月底,至少有57項公開招募的免疫治療藥物試驗。雖然免疫療法的臨床開發幫助患者更快地獲得最新療法,但多種治療組合的有效性在小樣本研究中始終受到質疑。
參考文獻
[1]Karasic TB, O"Hara MH, Loaiza-Bonilla A, et al. Effect of Gemcitabine and nab-Paclitaxel With or Without Hydroxychloroquine on Patients With Advanced Pancreatic Cancer: A Phase 2 Randomized Clinical Trial. JAMA Oncol. 2019 May 23. doi: 10.1001/jamaoncol.2019.0684.
[2]Zhang XP, Gao YZ, Chen ZH, et al. An EHBH-PVTT scoring system as an aid to decision-making on hepatectomy for HCC patients with PVTT: a multicenter study. Hepatology. 2019;69(5):2076-2090. doi: 10.1002/hep.30490.
[3]Flynn MJ, Sayed AA, Sharma R, et al. Challenges and Opportunities in the Clinical Development of Immune Checkpoint Inhibitors for Hepatocellular Carcinoma. Hepatology. 2019;69(5):2258-2270. doi: 10.1002/hep.30337.
版權申明
本文原創 如需轉載請聯繫授權
- End -
征 稿請註明:【投稿】醫院+科室+姓名
來稿以word文檔形式,其他不予考慮
你在看我嗎?
↓↓↓↓