在介紹過直接作用抗病毒藥物如核苷(酸)類似物(NAs)、HBV附著/進入抑製劑、基因編輯策略:cccDNA形成抑製劑、RNA干擾這4項靶點後,另有2種新靶點用於開發慢性B肝新藥,那就是核糖核酸酶H(RNase H)靶向性和核衣殼組裝抑製劑或稱核心抑製劑。

B肝在研新藥兩項靶點,核糖核酸酶H或核心抑製劑,詳解作用機制
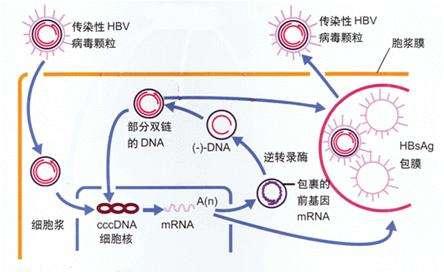
核糖核酸酶H(RNase H)靶向性,其作用機制是,先要認識包裹在病毒核心顆粒中的pgRNA是反轉錄合成(-)鏈DNA的模板。在這個過程中,pgRNA模板被聚合酶的RNase H結構域降解。核糖核酸酶活性抑製劑,將阻止這種情況發生,此外,還將阻止(+)-鏈DNA的後續合成。2020年下半年,研究人員發現,已經確定了許多潛在RNase H抑製劑的化學類別,包括a-羥基原克隆、N-羥基異喹啉二酮和N-羥基吡啶二酮。
針對上述發現,說明已經打開了它們單獨使用的可能性,或者更可能與其他現有的DAA(直接作用抗病毒藥物)或可能開發新DAA藥物結合使用。另一項靶點是,核衣殼組裝抑製劑或稱之為核心抑製劑,從目前全球科研B肝新藥方面,針對B肝病毒核衣殼或核心抑製劑研發新藥數量也是最多的,我們重點詳細介紹一下,關於核衣殼組裝抑製劑或核心抑製劑的作用機制。

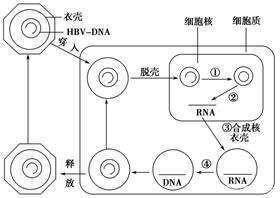
HBV核心蛋白在B肝病毒複製周期中起到核心作用,可以從rcDNA的解包與釋放、傳遞到核孔藍、核衣殼的形成與pgRNA的包裝,最後在形態發生的最後階段與B肝表面抗原(HBsAg)相互作用。現有間接證據表明,該蛋白與細胞啟動子結合並調節基因表達(結合cccDNA並改變cccDNA核小體間距)。在這方面,它構成了另一個有吸引力的B肝抗病毒靶點。
目前,藥物化學家已經發現了兩類核心蛋白變構調節劑(CpAM):雜芳基二氫嘧啶(HAPs)(I型CpAM)和苯丙酰胺(PPAs)、磺胺基苯甲酰胺和其他幾種化學類型(II型CpAM)。HAP衍生物,它可以誤導核心蛋白二聚體組裝異常的非衣殼聚合物,導致核心蛋白降解。例如,在研B肝新藥GLS4,就是HAP家族的代表性化合物(前期已有普及該研究藥物)。

而II型CpAMs可加速衣殼組裝的形成,可能發生在不合適的時間與地點,從而阻止pgRNA包被,反而誘導空衣殼的組裝。在體外,B肝在研新藥GLS4抑製病毒在肝細胞系上清液中的積累。這是在裸鼠體內使用HepAD38細胞進行的實驗,然後這些細胞生長為腫瘤,導致病毒血症。使用GLS4與bay41-4109治療小鼠,在治療期間與治療後,研究人員發現,其可以使HBV-DNA顯著而持續地下降到幾乎相同的程度。
口服 I型HBV核心抑製分子RO7049389,可誘導形成異常的HBV核心蛋白聚集體,這些聚集體隨後被耗盡,導致B肝病毒組裝中斷核HBV複製的有效抑製(前期已有普及B肝在研新藥RO7049389)。在體內,在給藥56天內,它誘導了大約3.0 log10 copies/mL的HBV-DNA下降。正在進行的第1期臨床研究觀察這種化合物的安全性、耐受性、藥代動力學和抗病毒活性。

研究了RO7049389單次和多次遞增劑量(SAD vs.MAD)下食物對劑量的影響。研究人員將未經治療的慢性B肝患者(ALT<5×ULN,無肝硬化)按劑量分為5組,觀察RO7049389的抗HBV作用。給藥4周後,觀察到5個隊列的HBV-DNA與HBV-RNA均下降,81.3%的患者HBV-DNA水準低於定量下限。然而,在治療的4周內每月觀察到B肝表面抗原(HBsAg)的變化。

小番健康結語:有趣的是,在對多種體外和體內HBV實驗模型研究中,I型核心抑製劑HAP_R01通過導致其22kDa前體蛋白前體的錯誤組裝,降低了HBV-DNA與e抗原水準。研究人員指出,似乎HAP_R01以及其他類似的CpAM,有可能獲得比目前批準的成人慢性B肝患者更高e抗體血清轉化率(2020年10月1日 Journal of Clinical Medicine)。返回搜狐,查看更多
責任編輯: