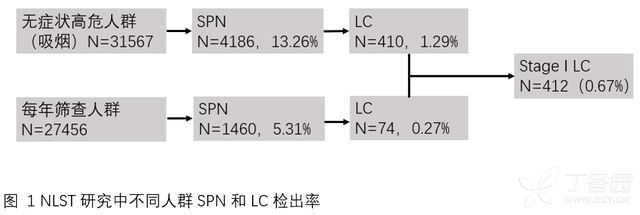
在臨床工作中,無論是體檢還是就診,患者肺部 CT 發現肺結節的情況非常多見,這時,很多患者都會問一連串讓醫生頭痛的問題,我的結節有沒有癌變的可能?要不要切掉?
通俗一點來說,如果有「危險」,那就提早動手,把它切除,以防後患。如果沒有「危險」,不妨觀察看看,畢竟,應該權衡利弊而避免過度醫療。
因此,應如何對肺結節進行正確的評估和動態觀察?如何判斷「這肺結節,是切還是留」?
今天,筆者將從孤立肺結節與多發肺結節兩部分入手,與大家分享如何對肺結節進行評估,以及需要注意的地方。
肺結節 (solitary pulmonary nodule, SPN) 的經典定義是被肺實質完全包圍的單發小病灶 (≤ 30 mm),通常邊界清晰。測得直徑不超過 30 mm 的病變稱為結節,直徑大於 30 mm 則稱為腫塊。
患者通常無癥狀,通常不伴有其他影像學特徵 (如肺門淋巴結增大、肺不張或胸腔積液)。
SPN 的病因可分為良性與惡性, 惡性 SPN 的常見病因包括原發性肺癌、肺轉移瘤和類癌腫瘤。良性 SPN 的常見病因包括感染性肉芽腫和良性腫瘤 (如錯構瘤)。較不常見病因包括血管性病變和炎性病變。
常見評估內容包括如下:
1. 一般情況評估
(1)患者年齡:惡性的概率隨患者年齡增加而增大。
35~39 歲:3%
-
40~49 歲:15%
50~59 歲:43%
60 歲及以上:50% 以上
(2)危險因素:如有吸煙史的患者,特別是當前吸煙的患者,其結節為惡性的概率總是更高(此前已有相當多的研究表明吸煙與肺癌相關)。
2. 影像學評估
對所有患者都應進行胸部 CT 掃描,最好是薄層 CT (層厚 1 mm)。對 SPN 的影像學檢查一般不需要對比增強。
可用於預測結節是否為惡性的 CT 特徵包括:結節大小、邊界、鈣化、密度以及生長情況。
(1)大小:
研究表明,結節大小 (通常以結節的最大直徑為指標) 是惡性病變的獨立預測因素。
-
結節小於 5 mm:低於 1%,
結節為 5~9 mm:2%~6%,
結節為 8~20 mm:18%,
結節大於 20 mm:高於 50%
(2)密度:
根據結節的密度,將其分為實性和亞實性。亞實性結節包括純磨玻璃密度的結節 (磨玻璃樣或非實性結節) 和含磨玻璃密度及實性成分的結節 (部分實性或半實性結節)。實性病變更常見,但部分實性病變的惡性可能性更高。
實性 SPN 呈緻密且均勻的病灶:小於 8 mm 的實性結節 (也稱為「亞厘米級」結節) 不太可能為惡性,且活檢難度大、功能顯像不能可靠地顯示其特徵,更可能通過 CT 掃描監測來隨訪。相反,不小於 8 mm 實性結節的惡性可能性較高、通過功能顯像能更可靠地顯示其特徵,更易通過活檢而成功診斷。
亞實性/非實性結節在影像學檢查上的密度低,所以透過這些結節可看見正常的實質結構,包括氣道和血管。應進一步評估這些結節有無實性成分,有則為部分實性結節,無則為純亞實性結節 (磨玻璃樣結節)。與實性結節相比,這些結節通常不易通過功能顯像發現或進行活檢。
CT 掃描上顯示存在超過 3 個月的亞實性病變,其惡性風險為 10%~60%,具體取決於結節大小和有無部分實性成分。CT 篩查研究表明,部分實性結節的惡性可能性更高,這些研究發現,在亞實性病變中發現實性成分是惡性病變的獨立預測因素。
(3)生長情況:
CT 是診斷和處理中用於評估結節生長或穩定性的經典手段。若連續的影像學檢查顯示 SPN 明顯生長,則其惡性風險高,往往有必要進行組織取材診斷。相反,保持穩定 2 年的實性結節和保持穩定 5 年的亞實性結節很可能為良性,可以避免立即行組織活檢。因此,對於表現為 SPN 的患者,應儘可能獲得以往的影像學檢查結果,最好是 CT。
評估癌症體積倍增時間 (volume doubling time, VDT) 的檢查,有助於預測 SPN 的惡性概率。
大部分惡性結節的 VDT 為 20~400 日,觀察發現典型類癌和浸潤前或低級別腺癌 (如,AIS 或 MIA) 的 VDT 更長 (>400 日)。因此,短期內 (<20 日) 增大的結節或長期 (>2 年) 保持穩定的結節,很可能是良性病變。這些數據主要適用於實性結節。而亞實性結節更可能見於早期或低級別腺癌,這類腫瘤的平均 VDT 更長。
(4)邊緣:
邊緣光滑 SPN 的惡性風險較低 (20%),
邊緣不規則 SPN 的惡性風險較高:邊緣呈細小深分葉的扇貝形邊緣 (分葉征)(60%)、毛刺征 (90%) 以及放射冠征 (95%)
(5)部位:
雖然惡性結節可見於任意肺葉,但是上葉結節的惡性概率更高。一項研究納入超過 7000 例結節,後來發現為惡性的 102 例結節中,幾乎有 2/3 位於肺上葉。此外,在 CT 上觀察到的 77 例葉間裂周圍結節,均非惡性病變。
(6)功能顯像:
由於癌症更可能代謝活躍,所以常用功能顯像來幫助區分良性與惡性結節。最常採用的功能顯像方法是 PET。
是否行 PET,取決於結節的惡性概率、大小和密度:
一般來說,惡性概率中等 (5%~65%) 的不小於 8 mm 實性 SPN,PET 診斷惡性病變的敏感性高 (72%~94%),對這類患者均應行 PET 進一步評估。這樣的結節 PET 的陽性率最高。病變對 FDG 的親和力以標準攝取值 (standardized uptake value, SUV) 來衡量通常用 SUV 大於 2.5 來辨別惡性概率高的 SPN,反映了臨床實踐中常用的臨界值。
3. 基本原則
一般來說,大於 30 mm 的結節通常手術切除,因為這類病變的惡性概率非常高,從而使切除的益處超過了手術相關風險。相反,對於不超過 8 mm 並且未證實出現生長的結節通常行連續 CT 掃描進行隨訪,因為這類病變的惡性概率低,而切除的技術難度大,切除的益處不超過手術相關風險。
因此,在這兩種情況下估算的惡性概率均不太可能影響診斷策略。然而,8~30 mm 結節的惡性風險及診斷策略有很大差異,我們需要綜合分析上面的資料,綜合考慮。
多發肺結節:孰良孰惡?問題的關鍵仍然是判斷良惡性:多發性肺結節可由惡性或良性病變引起。已知可引起多發性肺結節的良性病變包括感染、非感染性炎症疾病、動靜脈畸形 (AVM) 及塵肺等。
1. 對於已知存在原發惡性腫瘤的患者:
直徑大於等於 10 mm 或由常規X光檢出的多發性肺結節最常由實體器官原發惡性瘤轉移所致,而直徑小於 5 mm 且鄰近臟胸膜或葉間裂的多發性肺結節則更可能為良性病變,如肉芽腫、瘢痕或肺內淋巴結。
另外,對於已知存在惡性腫瘤的患者:直徑超過 5 mm 的多發性肺結節更可能為惡性而非良性。
2. 對於無已知原發性惡性腫瘤的患者:
如果多發性肺結節的直徑大於等於 1 cm 或由常規X光檢出,則最可能由實體器官惡性原發瘤轉移所致。
如果多發性肺結節的直徑小於 5 mm、鄰近臟胸膜或葉間裂,且為偶然檢出,則更可能為良性病變,如肉芽腫、瘢痕或肺內淋巴結。
3. 確定多發性肺結節的特徵:
螺旋、多層、多排 CT 通常為常規X光檢查後的首選診斷性檢查。
4. 定期隨訪:
如果臨床醫師綜合分析確信多發性肺結節很可能由良性疾病所致,則可通過連續 CT 掃描隨訪並定期再評估。
5. 需要手術的情形
放射影像學、病史及體格檢查結果提示惡性診斷。
若仍不確定多發性肺結節的病因,則需要組織取樣。組織取樣的方法包括:CT 引導下經胸穿刺活檢、經支氣管鉗夾活檢或穿刺活檢,以及通過電視輔助胸腔鏡手術或開放式胸廓切開術進行外科肺活檢。
應用靶向藥物導致患者死亡,忽視了哪一點?

主要參考文獻:
1. Gould MK, Tang T, Liu IL, et al. Recent Trends in the Identification of Incidental Pulmonary Nodules. Am J Respir Crit Care Med 2015; 192:1208.
2. Ost D, Fein AM, Feinsilver SH. Clinical practice. The solitary pulmonary nodule. N Engl J Med 2003; 348:2535.
3.Midthun DE, Swensen SJ, Jett JR. Approach to the solitary pulmonary nodule. Mayo Clin Proc 1993; 68:378.
4.Ost D, Fein A. Management strategies for the solitary pulmonary nodule. Curr Opin Pulm Med 2004; 10:272.
5.Mehta HJ, Ravenel JG, Shaftman SR, et al. The utility of nodule volume in the context of malignancy prediction for small pulmonary nodules. Chest 2014; 145:464.
6.Sawada S, Yamashita N, Sugimoto R, et al. Long-term Outcomes of Patients With Ground-Glass Opacities Detected Using CT Scanning. Chest 2017; 151:308.
7.Callister ME, Baldwin DR, Akram AR, et al. British Thoracic Society guidelines for the investigation and management of pulmonary nodules. Thorax 2015; 70 Suppl 2:ii1.
8.Calcagni ML, Taralli S, Cardillo G, et al. Diagnostic Performance of (18)F-Fluorodeoxyglucose in 162 Small Pulmonary Nodules Incidentally Detected in Subjects Without a History of Malignancy. Ann Thorac Surg 2016; 101:1303.
9.Wiener RS, Slatore CG, Gillespie C, Clark JA. Pulmonologists" Reported Use of Guidelines and Shared Decision-making in Evaluation of Pulmonary Nodules: A Qualitative Study. Chest 2015; 148:1415.
10.Moseson EM, Wiener RS, Golden SE, et al. Patient and Clinician Characteristics Associated with Adherence. A Cohort Study of Veterans with Incidental Pulmonary Nodules. Ann Am Thorac Soc 2016; 13:651.
11.Lee SM, Park CM, Lee KH, et al. C-arm cone-beam CT-guided percutaneous transthoracic needle biopsy of lung nodules: clinical experience in 1108 patients. Radiology 2014; 271:291.
12.Takeshita J, Masago K, Kato R, et al. CT-guided fine-needle aspiration and core needle biopsies of pulmonary lesions: a single-center experience with 750 biopsies in Japan. AJR Am J Roentgenol 2015; 204:29.
13.Revel MP, Merlin A, Peyrard S, et al. Software volumetric evaluation of doubling times for differentiating benign versus malignant pulmonary nodules. AJR Am J Roentgenol 2006; 187:135.
14.de Hoop B, Gietema H, van de Vorst S, et al. Pulmonary ground-glass nodules: increase in mass as an early indicator of growth. Radiology 2010; 255:199.