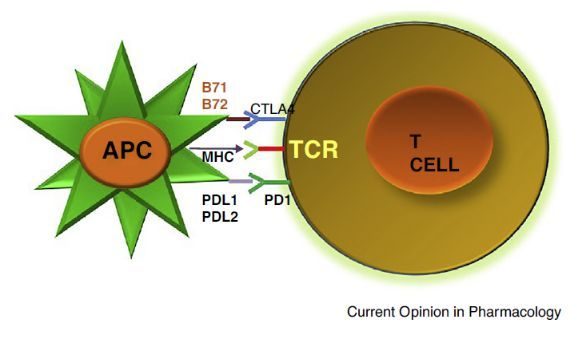
CSCO肺癌免疫治療專場——如何提高免疫治療有效率。
作者丨Chemo
來源丨醫學界腫瘤頻道
9月下旬,CSCO年會於廈門國際會議中心盛大召開。在肺癌免疫治療專場中,來自中國醫學科學院腫瘤醫院的王潔教授分享了專題:如何提高免疫檢查點抑製劑二線治療的療效。隨著納武利尤單抗獲批用於EGFR/ALK陰性的晚期或轉移性非小細胞肺癌(NSCLC)二線治療,這一專題解讀似乎來得十分應景。
十多年來,隨著靶向治療及其他治療手段的進步,NSCLC的總體生存狀況得到了一定提升。美國SEER資料庫最新數據顯示[1],NSCLC總體5年生存率達到了18.6%,但對於發生遠處轉移的晚期NSCLC患者,5年生存率仍然僅有4.7%。而免疫治療出現後,這一局面被打破,晚期NSCLC的5年生存率首次提高到了16%[2],相比4.7%翻了近三倍。不同於直接殺傷腫瘤細胞的傳統腫瘤治療手段,免疫檢查點抑製劑是利用機體自身的免疫系統殺傷腫瘤。
-
一方面,抗腫瘤免疫應答通過持續識別和記憶腫瘤抗原,隨時間不短增強和擴大。
另一方面,隨著免疫應答的擴大,一些細胞毒性T細胞分化為成熟記憶T細胞。即使在原始抗原刺激不存在時,這些細胞依然能夠提供長期免疫記憶保護。
儘管免疫治療相比傳統療法,顯著改善了患者的總生存狀況,但仍然有一個問題不可迴避,即免疫檢查點抑製劑單葯總體響應率偏低。
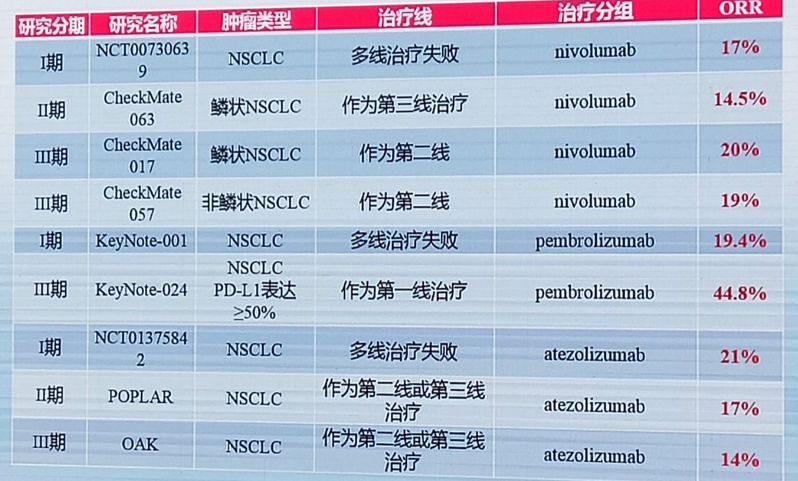
從上面這張圖我們看到,除了Keynote 024研究中,帕博利珠單抗在PD-L1表達率≥50%的NSCLC患者中,客觀緩解率(ORR)達到了44.8%,其餘研究中,免疫檢查點抑製劑的ORR幾乎都徘徊在20%以下。
那麼,該如何提高免疫檢查點抑製劑二線治療的療效呢?
一
利用生物標記物精準識別獲益人群
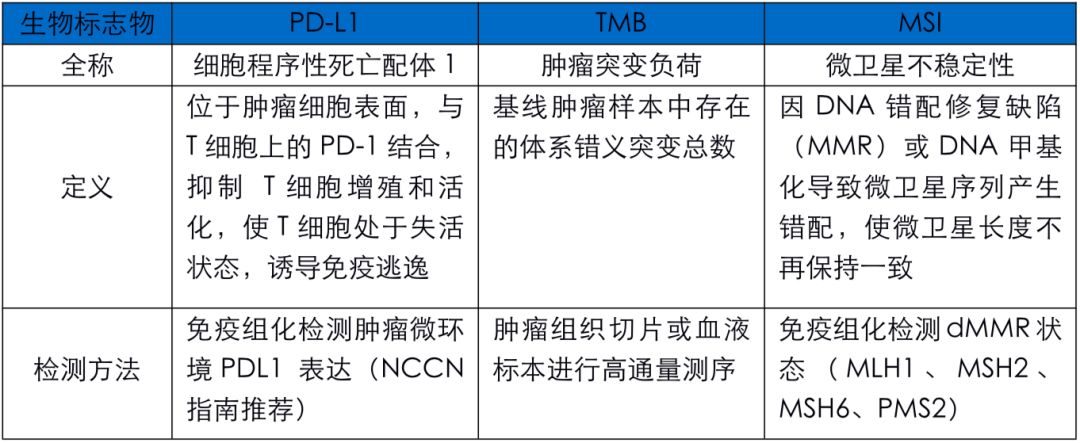
免疫治療中生物標記物(biomarker)的概念,儘管被提出不過兩三年,但已經漸漸為大家所熟知,包括PD-L1、TMB、CD8+ T細胞密度、TCR序列分析等,但需要指出的是,任何單一的生物標記物用於指導免疫治療均具有局限性,「多重」生物標記物是未來的發展方向。
PD-L1
PD-L1的表達是最為大家熟知的免疫治療biomarker之一,下面這張表回顧性地總結了CheckMate 017[3]、CheckMate 057[3]、Keynote 010[4]、OAK[5]研究中,PD-1/PD-L1單抗二線治療晚期NSCLC基於PD-L1表達的總生存(OS)數據。
可以發現,在非鱗狀NSCLC中,PD-L1表達率越高,患者OS獲益越顯著;而在鱗狀NSCLC中,PD-L1表達率似乎對患者OS獲益指導意義不強,仍需要尋找新的biomarker。
腫瘤突變負荷(TMB)
TMB是另一個廣受關注的biomarker。下圖中,2015年發表於Science的研究和2017年發表於NEJM的CheckMate 026研究[6]分別探討了TMB與免疫治療療效之間的關係。

從無進展生存(PFS)曲線走勢可以看出,TMB與免疫抑製劑單葯二線療效在NSCLC中存在顯著相關性。相比低TMB(﹤10 Mutations/Mb)的患者,高TMB(≥10 Mutations/Mb)的患者接受免疫檢查點抑製劑單葯治療中位PFS顯著延長。

然而又一個問題出現了,並非所有的患者都能夠進行TMB檢測。在CheckMate 026研究中,有42%的標本不符合TMB檢測要求。我們知道,晚期肺癌中常規的免疫組化、EGFR、ALK的檢測都需要腫瘤組織,而TMB檢測對腫瘤組織的獲取量和品質要求都比較高,尤其在二線、三線治療,重復活檢變得更加困難。
隨著技術的進步,除了組織標誌物,血液標誌物、影像標誌物也逐漸得到發展,血液和影像標誌物均無創、樣本易獲得、且可以動態監測。
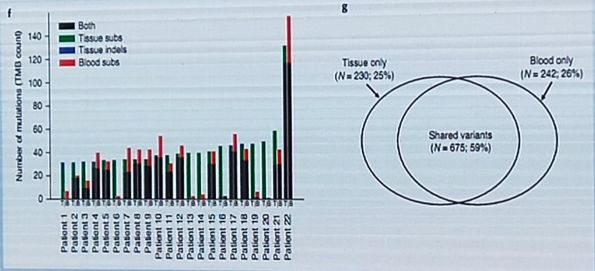
-
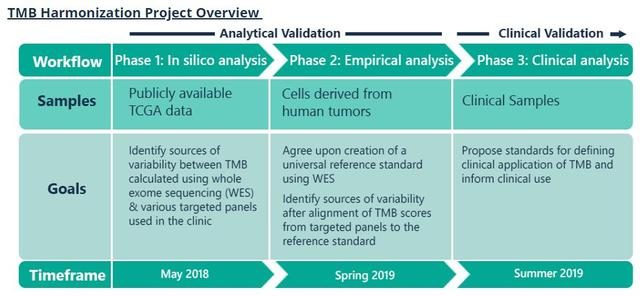
到底需要多大的panel:基因數/Panel Size的優化?
-
選擇納入哪些基因:基因的選擇對計算TMB有影響嗎?
-
哪些變異形式應該納入:演算法的優化,例如同義突變及indel?
-
應該進行基於panel的bTMB與基於WES組織TMB對比。
需要在ICB治療組中進行bTMB預測價值的分析。
二
火眼金睛,早期識別假性進展、超進展
假性進展的鑒別
假性進展是免疫治療的一項獨特反應模式,表現為腫瘤負荷增大,但患者可以獲益從而達到客觀緩解或疾病穩定。出現假性進展原因主要有:當淋巴細胞浸潤腫瘤時,腫塊可能表現為增大或新病灶出現;另外達到適應性免疫反應需要一定時間,假性進展可能表現為腫瘤持續增長直至達到一定程度的緩解。

所以對於免疫治療中,出現腫瘤增大的患者,不要急著停葯,需先評估患者的系統癥狀和PS評分,如果患者癥狀穩定或改善,提示可能為假性進展。
此外,假性進展的鑒別可以藉助ctDNA動態監測。如果ctDNA含量表現為隨治療下降,則可能為假性進展。

超進展
超進展(HPD)也是免疫治療中比較特殊的表現。目前HPD還沒有比較公認的定義,一些研究認為:根據RECIST標準,與基線相比,治療期間首次評估療效時腫瘤生長速率≥基線的兩倍的增加為HPD。
HPD並不是免疫治療特有,在crizotinib、sorafenib、及vemurafenib等TKI治療後,也觀察到超速進展。

目前的研究發現,HPD與年齡存在顯著相關性,19%的HPD患者年齡≥65歲。HPD與腫瘤負荷、治療線數無相關性,PD-1抑製劑和PD-L1抑製劑在HPD上無明顯差異。另外有研究觀察到,出現HPD的患者多存在MDM2基因擴增。
基於以上證據,我們可以在免疫治療過程中通過監測基因突變、關注HPD高風險人群,從而做到未雨綢繆,防止HPD突髮狀況。
三
探尋合適的治療時間
關於免疫治療的持續時間,目前的研究表明,1年的療效不如2年。
CA209-003和KeyNote-010研究表明:PD-1抑製劑治療2年後停葯,大部分患者仍在持續應答。免疫治療的治療時間是2年還是持續治療,目前尚沒有定論。
四
進一步探索聯合策略
目前,免疫治療二線都是單葯,對於PS評分較好的患者,或許可以考慮聯合治療。
另外對於驅動基因陽性、一線靶向治療後耐葯的患者,以及突變負荷高、突變混亂,沒有較好靶向治療對策的患者,也可能是免疫治療的合適人群。
總結-
目前仍有約60%的NSCLC患者治療手段非常有限,生存預後不理想;
-
多種PD-1/PD-L1抑製劑已經成為新二線NSCLC治療標準;
-
未來通過biomarker的研究精準識別獲益人群以促進二線免疫治療的療效;
精細化的分層基礎上的合理的聯合策略是未來的探索方向。
參考文獻
[1] Surveillance, Epidemiology, and End Results Program (SEER) stat Fact Sheets: Lung and Bronchus cancer. Available at: http://seer.cancer.gov/statfacts/html/lungb.html.Accessed June, 2018
[2] Scott Gettinger, et al. J Clin Oncol. 2018; Mar 23:JCO2017770412.
[3] Leora Horn, er al. J Clin Oncol. 2017;35:3924-3933.
[4] Roy S Herbst, et al. Lancet 2016;387: 1540-50.
[5] Rittmeyer A, et al. Lancet 2017;389:255-265.
[6] N Engl J Med. 2017 Jun 22;376(25):2415-2426.
[7] N Engl J Med. 2018 May 31;378(22):2093-2104.
[8] Nat Med. 2018 Aug 6. doi: 10.1038/s41591-018-0134-3.
[9] JAMA Oncol. 2018 Feb 8:el175332.
[10] Ann Oncol. 2017 Aug 1;28(8):1988-1995.