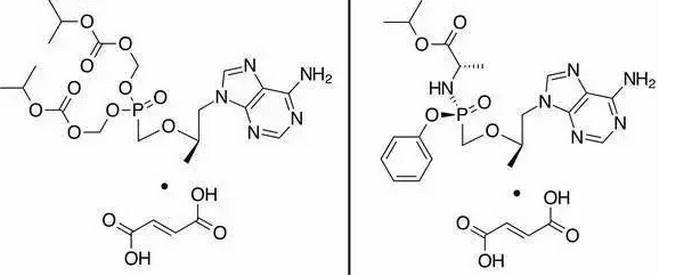
富馬酸替諾福韋艾拉酚胺(TAF)是一種新型靶向肝髒的低劑量核苷類藥物已經進入第4期上市期。但是,小番健康留意到TAF的1-3期臨床試驗主要針對成人慢性B肝患者,即有年齡限制,而在兒童以及青少年慢性B肝感染者中尚未進行過臨床試驗。接下來,介紹一項吉利德科學啟動的TAF用於兒童、青少年臨床試驗。

B肝替諾福韋艾拉酚胺試驗,Plase2臨床啟動,面向兩個年齡層
由美國吉利德科學主辦,登記於臨床試驗數據庫(見下圖),試驗題目:替諾福韋艾拉酚胺(TAF)治療兒童青少年慢性乙型肝炎病毒感染,首次發布時間:2016年10月13日,最新發布時間:2020年8月6日,實際研究開始時間:2016年11月,預期初步完成時間:2023年2月,預期研究完成時間:2027年11月。官方預計招募報名人數是150人。
研究主要分為兩個隊列,隊列1主要評價TAF25毫克每日給藥1次,對比安慰劑治療24周的青少年(12歲至<18歲)的安全性、耐受性以及抗病毒活性(HBV-DNA<20iu/mL);隊列2主要分為A和B兩部分,其中A部分評估TAF和替諾福韋(TFV)的穩態PK,確定兒童(2歲至<12歲)CHB每日1次的TAF給藥劑量。B部分評價48周時TAF的安全性和耐受性,以及24周時用於兒童(2歲至<12歲)CHB抗病毒活性(HBV-DNA<20iu/mL)以及作用。

雖然,富馬酸替諾福韋艾拉酚胺(TAF)已經上市,但應遵醫囑使用抗病毒藥物,關注TAF適應症和適用人群,因為該藥臨床前與人體臨床試驗尚未在2歲至<12歲、12歲至<18歲兩個年齡層中進行,因此,吉利德科學本項試驗主要是觀察TAF在兒童和青少年受試者中的藥物動力學、安全性以及抗病毒作用。本研究為隨機、雙盲、安慰劑對照試驗,TAF(隊列1)體重大於或等於35公斤的受試者(12歲至<18歲),將服用TAF25毫克片劑,為期24周,TAF每日1次;
安慰劑對照組(隊列1)體重大於或等於35公斤的受試者(12歲至<18歲),將服用安慰劑片24周,安慰劑每日1次;實驗性TAF(隊列2第1組)體重大於或等於35公斤的參與者(6歲至<12歲),將接受TAF25毫克片劑,為期24周,TAF每日1次;TAF(隊列2組2)體重大於或等於17公斤至小於25公斤的參與者(6歲至<12歲),將接受TAF15毫克片劑,為期24周,TAF每日口服1次;

TAF(隊列2組3)體重小於17公斤、無法吞咽片劑的受試者(2歲至<6歲),將接受口服TAF顆粒(劑量待定)為期24周,TAF每日口服1次;TAF(隊列2安慰劑)參與者,將接受相匹配的安慰劑TAF(片劑或口服顆粒)24周,安慰劑每日口服1次;開放標簽TAF經過24周的隨機盲法治療,參與者將有資格參加開放標簽延長期,接受額外216周TAF治療。
根據登記於美國臨床試驗數據庫信息,本試驗不接受健康志願者,符合試驗條件的年齡:2歲至17歲(兒童),關鍵入選標準:男性和非懷孕、非哺乳期女性,隊列1=體重大於或等於35公斤;隊列2第1組=體重大於或等於25公斤;隊列2組2=體重大於或等於17公斤至小於25公斤;隊列2第3組=體重小於17公斤;願意並能夠提供書面知情同意書;B肝表面抗原陽性大於或等於6個月的慢性B肝書面證據;估計肌酐清除率(CLCr)≥80 mL/min/1.73m^2(使用Schwartz公式);心電圖正常者。

關鍵排除標準:母乳餵養的女性;研究期間,不願意使用“有效”方案進行規避避孕方法具有潛在生殖能力的男性和女性;混合感染HCV、HDV、HIV;有肝癌證據者,具體如甲胎蛋白大於50 ng/mL,應進行影像學研究;甲胎蛋白小於50 ng/mL,則無需進行影像學研究;是否存在肝功能失代償性病史或當前已有證據;血液生化指標異常者;非B肝病因的慢性肝病者,例如膽管炎、α-1抗胰蛋白酶缺乏症、血色素沉著症;
接受實體器官或骨髓移植者;當前正處於使用免疫調節劑或免疫抑製劑治療者;研究人員認為存在嚴重的腎髒、心血管、肺或神經系統疾病者;篩查前,5年內有惡性腫瘤。正處於評估可能的惡性腫瘤個人不符合資格。判斷受試者是否可能受到酒精濫用影響。小番健康結語:以上就是關於TAF應用於兒童和青少年的人體臨床試驗登記信息,信息來自臨床試驗數據庫,預計初步結論將於2023年2月完成,吉利德科學於今年8月6日更新過一次本試驗信息。返回搜狐,查看更多
責任編輯: