現有已在國外上市,但未在國內上市的B肝新藥Besivo(besifovir),領導Besivo(besifovir)研究的韓國延世大學醫學院教授Ahn Sang-hoon曾經有過這樣對Besivo的評價:Besivo的安全性是其重要優勢,在降低TDF引起的腎毒性和骨毒性後,這會使其上市後具備更高安全性,考慮到慢性B肝患者需要持續5-10年用藥,用藥周期可能延長,對藥物安全性而言十分關鍵。

B肝新藥Besivo上市監測,安全性高於TDF,尺寸為其2倍
Besivo(besifovir),即馬來酸貝西福韋酯,是已上市迎來監測期的B肝新藥。但是,在行業內人士看來,其進入B肝藥品市場則有相當難度,因為已上市新藥Besivo有2個方面不足:第一是Besivo的尺度較大,有17.0-mm寬,是美國吉利德科學的富馬酸替諾福韋二吡呋酯片(TDF)的2倍大小;第二是Besivo會出現1種氨基酸:左旋肉鹼的減少。基於以上不足,自主研發Besivo的韓國日東製藥株式會社建議,服藥時可將藥物掰為2片後服用,且已注意到該藥服用不便的問題。
上市後,Besivo迎來監測以評估其安全性和有效性的階段,臨床試驗編號:NCT03642340,開始於2017年5月15日,最近1次更新於2018年8月31日,由韓國日東製藥主辦的上市後密切監測試驗,預計2023年5月14日初步完成,2023年8月15日整體完成(見下方臨床試驗數據庫)。Besivo已上市但尚有不足,韓國日東製藥也曾對Besivo作出明確說明:

Besivo可導致氨基酸左旋肉鹼自主合成減少的問題,建議服用韓國日東製藥旗下另外1種藥物:L-Carn,從而能夠補充左旋肉鹼。延世大學醫學院教授Ahn Sang-hoon指出,在臨床研究中雖然發現受試者需要補充2片的L-Carn,但是,進入到第3期臨床試驗時,受試者僅僅只要服用1片L-Carn。多服用1片L-Carn的確會給患者帶來不便,但Ahn教授認為,Besivo自身優勢依然明顯,優勢超出需要額外服用1片L-Carn所帶來的不便(來自延世大學醫學院教授Ahn原文英譯點評)。
Besivo更主要是面向韓國國內的慢性B肝患者,該藥迎來上市後監測,本研究目的是監測Besivo的不良事件和有效性,共納入3000名慢性B肝患者,且研究已於2017年5月15日開始,將於2023年中下旬完成。研究人員關注的主要結果指標包括給藥48周後的不良事件,不良事件的描述包括類型、開始/結束日期、嚴重程度、采取的措施、與藥物的因果關係以及研究人員對不良事件的方法,無論是否與藥物有關,直到監測期內隨訪超過1次;

實驗室異常和生命體征的變化,只有在導致研究終止、必須進行治療醫療乾預和或研究者認為它們是不良事件時,才被視為不良事件。給藥後48周,一般醫學實踐中本次給藥後嚴重不良事件發生率。Besivo的上市後監測研究入選年齡為20歲以上成人或老年人,不接受健康志願者,採用概率抽樣法進行。此外,應滿足入選篩查前,B肝表面抗原陽性超6個月以上或確診為慢性B肝病毒感染,並使用Besivo的慢性B肝患者。
研究對19歲年齡以下的慢性B肝患者、對左旋肉鹼有禁忌者、對Besivo或其成分反應過度者均排除在本次研究以外。Besivo是目前韓國已上市藥物中,安全系數相對較高的抗病毒藥物,主要特點為降低骨骼與腎髒毒性,研究人員分析,考慮到慢性B肝長期用藥規律,通常在5至10年甚至是終身服藥,藥物使用周期可能延長,就需要更高安全系數來保障持續用藥。

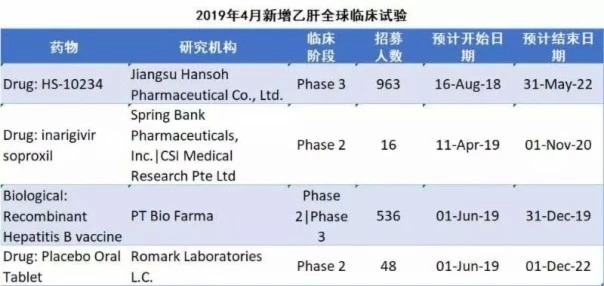
全球臨床試驗數據庫
小番健康結語:以上試驗登記信息和上市後監測數據來自臨床試驗數據庫與Besivo登記信息。Besivo優劣勢均比較明顯,相比較安全性有所提高,要比TDF尺寸大2倍給慢性B肝患者帶來更多給藥不便。此外,延世大學醫院教授 Ahn也指出,長期服用Besivo後會出現體內1種氨基酸左旋肉鹼的減少,基於以上原因,研究人員啟動上市後監測以評估Besivo的安全性和有效性。
可以看到,現有已上市B肝藥物有優點有不足,通過介紹試驗目的、試驗設計以及方法,可以讓同行業研究人士了解科學實驗重要性。此外,對廣大讀者也能夠滿足了解全球B肝新藥研發試驗進展情況。本項上市後監測Besivo安全性與有效性,由韓國日東製藥主辦完成。返回搜狐,查看更多
責任編輯: