▎醫藥觀瀾/報導
今日,侖勝醫藥(Sinovant Sciences)宣布,其derazantnib臨床試驗申請已被中國國家藥品監督管理局藥品審評中心(CDE)正式接受,準許開展治療FGFR2基因融合陽性且至少一線系統治療失敗的不可手術切除或晚期肝內膽管癌(iCCA)受試者的註冊臨床試驗。這是侖勝醫藥繼本月初宣布在中國成立細胞療法公司後的又一新進展。
Derazantinib是成纖維細胞生長因子受體(FGFR)家族的一種強效口服抑製劑,此受體家族主要驅動細胞的增殖、分化和遷移。據悉,侖勝合作夥伴Basilea公司正在針對美國和歐洲含有FGFR2融合基因的二線iCCA患者進行一項類似的全球註冊研究。


膽管癌(CCA)是最常見的膽道惡性腫瘤,也是僅次於肝細胞癌(HCC)的第二大肝臟惡性腫瘤。根據腫瘤位置不同,CCA分為肝內(iCCA)、肝門(pCCA)和肝外(eCCA)。iCCA起源於肝內膽管系統並形成肝內腫塊,是一種侵襲性癌症,早期患者的5年中位生存率為15%。有數據顯示,中國是世界上iCCA發病率最高的國家之一。在中國人口集中的城市,膽管癌的發病率超過每10萬人7例,且以肝內膽管癌為主。
作為一款口服泛FGFR抑製劑,該藥物是iCCA和其它因FGFR突變引起癌變的腫瘤潛在治療方法。據悉,在針對含有FGFR2基因融合的iCCA患者的臨床1/2期研究中,derazantinib的客觀緩解率為21%,比標準化療高近3倍。
侖勝醫藥總裁原瑞華博士表示:「iCCA是腫瘤疾病裡未滿足的醫療需求之一,尤其在中國需求比西方國家更大。目前二線患者的現有療法均不理想,沒有一種療法能有效延長患者的生存期或減輕疾病負擔。Derazantinib有望成為中國首個獲批治療這一惡性腫瘤的藥物,我們期待在今年晚些時候我們的註冊項目開始招募患者。」
「我們對CTA獲批感到十分欣喜,這讓侖勝離為中國患者帶來derazantnib更近了一步。」侖勝醫藥董事長陳希楠表示:「侖勝為iCCA患者不斷推進derazantinib研發進展的舉措,踐行了我們致力於解決中國重要公共衛生問題的承諾。」
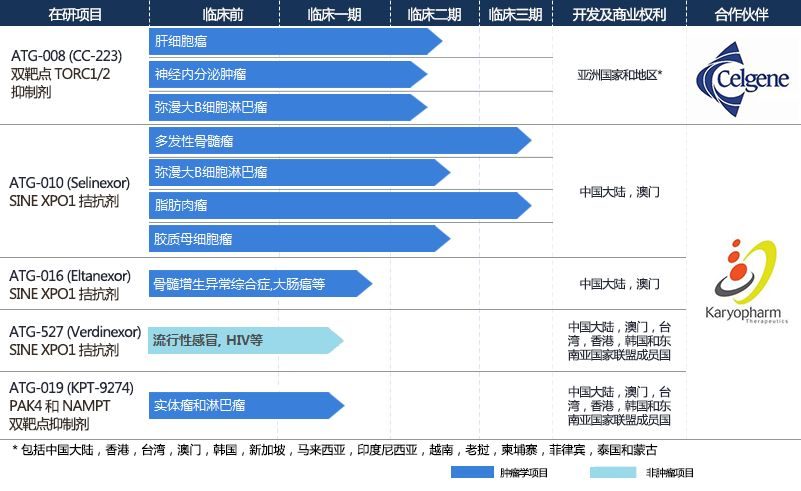
侖勝醫藥是一家生物醫藥公司,由包括「海歸」華人科學家和醫生在內的團隊創立,並得到了中信產業基金和全球性醫療集團Roivant Sciences的投資支持。根據其官網資料,目前公司擁有有13種多樣化的在研藥品,其中5種候選藥物已近進入臨床3期或更後期階段,涵蓋腫瘤學,傳染病,腎臟疾病,代謝疾病,肺病,腸胃病,皮膚病和罕見病等多個疾病領域。


相關閱讀:
資料來源:
[1]中國國家藥品監督管理局正式批準侖勝醫藥Derazantinib臨床試驗申請. Retrieved April 29, 2019, from https://www.prnasia.com/story/244288-1.shtml