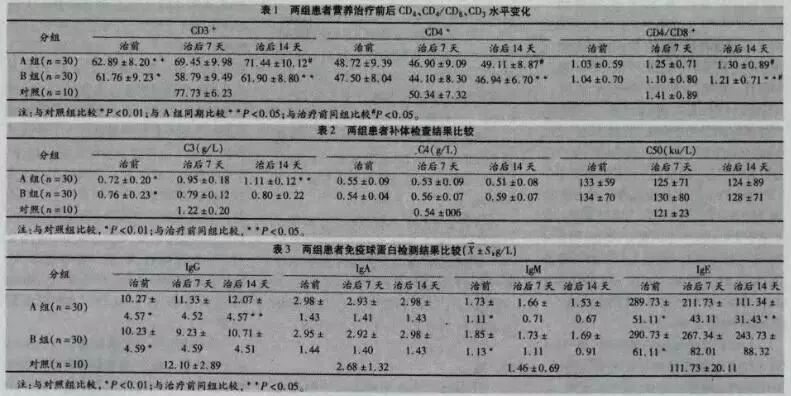
神奇的腸道——殺死有害菌,保護共生菌
人體腸道內居住著多達百兆的細菌「居民」,僅僅一「牆」之隔就是富含固有和適應性免疫細胞的腸道固有層,而這道「牆」只是一層腸上皮細胞(intestinal epithelial cells,IECs)。腸道中的這些細菌既有通常無害的共生菌,又有致病菌,它們的很多分子特徵都是相同的,而且都可以被免疫細胞的模式識別受體(pattern recognition receptors,PRRs)所識別並結合。免疫系統在抗擊病原菌的同時,是如何恰當地進行調節以不傷害共生菌群的?如果免疫系統不能應對病原菌的攻擊,機體的腸道屏障就極有可能被攻破,從而引發全身感染;而如果免疫應答過激,則會牽連共生菌群,導致組織損傷和菌群失調,並促使炎症性腸病(inflammatory bowel disease,IBD)的發生。
目前的觀點認為,粘膜免疫系統既有能力對病原菌產生有力的保護性應答,與此同時又對共生菌耐受。而且這一過程必須在生物多樣性動態平衡的背景下實現,因為隨著不同食材的攝入,腸道內環境改變,腸內微生物多樣性也會隨之快速波動。

細菌分解膳食纖維的副產物——SCFA
人們很早以前就已經認識到了共生菌對消化植物澱粉、膽汁酸產物以及為機體提供維生素的必要性。這些過程中會有很多副產物產生,而觀察發現,IBD患者體內的這些副產物相對較少,那麼這些微生物代謝產物是否決定了腸道的免疫狀態呢?很多研究團隊都對這一問題進行了探究。2014年的《美國國家科學院院刊》上,美國耶魯大學醫學院的Chang PV等發表的一篇論文發現,細菌對澱粉進行無氧酵解所產生的最終產物——n-丁酸,一種短鏈脂肪酸(short-chain fatty acid,SCFA),能起到抗炎的作用,並且能抑製腸內巨噬細胞所引起的促炎反應。
在這項研究中,Chang PV等證實,結腸內富集程度非常高的一種細菌代謝產物n-丁酸能夠通過抑製組蛋白去乙醯化酶(histone deacetylase,HDAC)調節腸巨噬細胞的功能。n-丁酸作為細菌的「信使」,告訴宿主的免疫系統產丁酸菌已經達到了一定水準。而HDAC負責做n-丁酸的「感受器」,大量n-丁酸導致的HDAC抑製最終會引起腸巨噬細胞減少促炎因子(如IL-6、IL-12)的產生,其效果就是腸道免疫系統對這些友好的產丁酸菌不產生炎症應答。而一旦缺少這些有益的細菌,固有層巨噬細胞就會通過產生促炎因子來清除它不歡迎的菌群,改造腸內的菌落環境,直到再次形成最佳的微生物平衡,n-丁酸水準回歸到理想範圍。
這一發現聯合其他一些新出現的證據共同提示,某些種類的細菌能夠通過它們的代謝產物來左右免疫系統,從而影響免疫應答的程度和性質。
SCFA促使Treg生成
此前一直認為,特定種屬的細菌與腸組織內某些T細胞亞群的出現有關。例如,給小鼠隻植入單一一種共生菌——分節絲狀菌(segmented filamentous bacteria,SFB)就足以誘導CD4+T細胞Th17亞群的產生(如下圖中的A)。這類細胞分泌促炎細胞因子IL-17和IL-22,可促使抗菌肽的產生、促進組織修復,並增強抗枸櫞酸桿菌感染的能力。另一種途徑也可以促使Th17細胞的產生——腸道固有層內的樹突狀細胞(dendritic cells,DCs)感受到腸腔內細菌來源的ATP,從而增加IL-6和IL-23的表達,這些細胞因子便具有誘導Th17產生的作用(如圖A)。然而,SFB定植鼠腸內ATP的水準並沒有增加,這提示,多種能感受到特定微生物定植的途徑最後都能誘導出同樣的免疫表型。這一結論同樣適用於結腸內調節性T(regulatory T,Treg)細胞的產生。
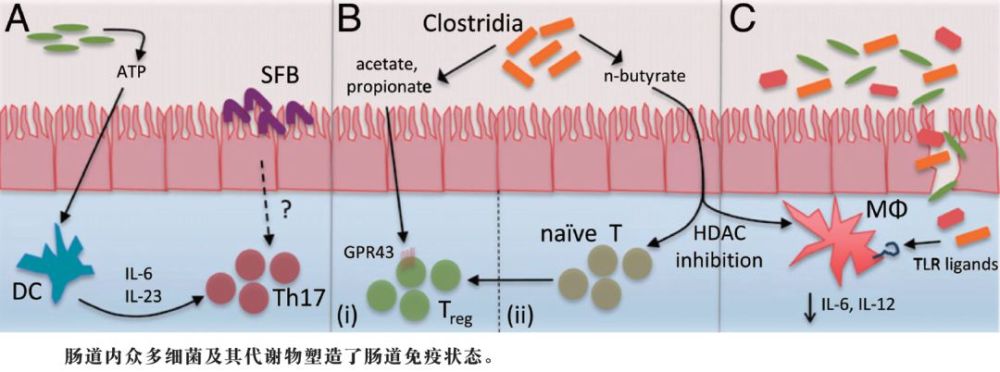
日本理化學研究所(RIKEN)綜合醫學研究中心的Atarashi K等2013年發表於《自然》上的文章顯示,從人的糞便中分離出梭菌屬IV、XIVa及XVIII簇細菌,並將其植入小鼠,可提高小鼠腸內Treg細胞的富集程度,還能增加細胞因子IL-10等抗炎分子的產生(如圖B)。把得自於這些小鼠的盲腸提取物應用於人體及鼠IEC細胞系可導致轉化生長因子(transforming growth factor,TGF)-β1的產生,TGF-β1是腸內參與Treg細胞分化的一種主要細胞因子。這種盲腸提取物中含高濃度的SCFA,而體外實驗顯示,給IECs加入由純化乙酸、丙酸和丁酸(都是SCFA)組成的混合物同樣能誘導TGF-β1的產生。這些結果提示,梭菌屬細菌代謝產生的SCFA或許才是Treg細胞計數增加的原因。
無獨有偶,哈佛公共衛生學院的Smith PM等2013年發表於《科學》上的研究也得出了類似的發現:口服SCFA時,可通過結腸Treg細胞上表達的短鏈遊離脂肪酸受體——G蛋白藕連受體43(G protein-coupled receptor 43,GPR43)促進Treg細胞擴增,為實驗性結腸炎模型提供保護。而在此之前,炎症反應的減輕被認為是由微生物代謝產生的乙酸通過表達於中性粒細胞和嗜酸性粒細胞上的GPR43所介導。GPR43信號被認為可抑製炎症反應,在結腸炎、炎症性關節炎及過敏性呼吸系統疾病的動物模型中可使病情得到改善。
SCFA的抗炎效果不僅可以通過與G-蛋白藕連受體(G protein–coupled receptors,GPCRs)結合這一途徑產生,而且現已證明還可以不依賴於GPCRs機制。2013年,兩項發表於《自然》上的研究——分別由日本RIKEN的Furusawa Y等和美國紀念斯隆-凱特林癌症中心的Arpaia N等開展——均證實,SCFA對HDAC活性的抑製可導致從CD4+幼稚T細胞前體開始的Treg細胞從頭生成過程(如圖B)。這完全不同於GPR43信號作用下的對結腸已有Treg細胞池的擴增。每種SCFA誘導Treg細胞生成的能力都與HDAC被抑製的程度呈正相關,n-丁酸的能力最強。HDAC被抑就導致誘發Treg細胞所需的基因位點內的組蛋白H3乙醯化增加,從而使這些基因的轉錄上升。此外,用丁酸預處理的DC,促炎信號明顯減少,而且在丁酸和TGF-β1共同存在的情況下,會進一步促使幼稚CD4+T細胞轉化為Treg細胞。
n-丁酸對腸巨噬細胞的作用
根據Chang等的這項研究,n-丁酸對腸巨噬細胞的抗炎作用也取決於HDAC抑製,並與組蛋白3第9賴氨酸的乙醯化(histone 3 lysine 9 acetylation,H3K9Ac)水準升高相關(如圖C)。
腸巨噬細胞是腸道固有層內最豐富的免疫細胞類型,由於它們不能增殖,所以只能從循環單核細胞池中招募、補充。然而,不同於循環單核細胞及其他組織中的巨噬細胞,腸巨噬細胞上的Toll樣受體(toll-like receptor,TLR)對刺激的敏感性較低,應答並不充分。這些都提示,肯定有某種活性過程在骨髓來源細胞到達腸道固有層後抑製了其炎症應答反應,導致在這一存在微生物信號的小環境中,TLR對配體的應答不足。
Chang等的研究給出了其中的原因。首先,用n-丁酸處理骨髓來源巨噬細胞(bone marrow–derived macrophages,BMDMs)後,就足以使其在應對細菌內毒素——脂多糖(lipopolysaccharide,LPS)時,TLR與之結合後所誘發的炎症反應減輕。隨後,用廣譜抗生素治療小鼠來清除由細菌群落所產生的SCFA,再給它們中的一部分補充n-丁酸,另一部分只是補充些充當安慰劑的賦形劑,結果顯示,腸巨噬細胞反應性的降低取決於SCFA的存在,如果沒有SCFA則腸巨噬細胞就會重新獲得對LPS應答的能力。
如上所述,這一效果的產生取決於n-丁酸的HDAC抑製活性,當用一種經典的HDAC抑製劑——曲古黴素A(trichostatin A,TSA)處理BMDM時,也會出現類似的效果。有趣的是,n-丁酸作用下巨噬細胞反應性的降低並非是由於全部基因的表達都受到了影響。只有LPS次級反應基因(secondary response genes,SRGs),例如Il6的轉錄是被削弱的。
LPS通過巨噬細胞上的TLR可以誘導數百種基因的表達,這些基因的表達按照是否需要新蛋白的合成又可以被分為兩個階段:初級反應基因(primary response genes,PRGs)和SRGs。PRGs通常在刺激發生1小時內轉錄表達,而SRGs由於要等待新蛋白合成及啟動子處染色質重構,所以其表達是延遲的。
在n-丁酸作用下,巨噬細胞內作為LPS PRGs的Tnfa和Ccl2——這兩種基因分別編碼TNF-α和單核細胞趨化因子1(monocyte chemotactic protein-1,MCP-1),都不受n-丁酸的影響。相反,編碼促炎細胞因子IL-6和IL-12p40的SRG基因在暴露於n-丁酸時受到了強烈的抑製。
有人提出,SRG表達的調節可能是細胞系特異性的。n-丁酸可能通過協調染色質修飾來提高核小體改構的閾值,從而實現對SRG的選擇性抑製。Chang等的研究結果支持了這一假說,他們的研究顯示,n-丁酸暴露後,基因Il6和Il12b位點都出現了H3K9Ac的累積。儘管組蛋白乙醯化是與轉錄激活相關的,但也有報導稱,H3K9Ac修飾可使Mi-2β增加,這是一種Mi-2/NuRD共抑製複合物,在HDAC被抑製的時候其表達上調。更重要的是,Mi-2β在SRG位點的聚集會使LPS介導的SRG基因表達上調得到抑製。
Chang等的這項工作提供了一種前所未有的機制,解釋了為什麼腸巨噬細胞對腸腔內的細菌刺激反應性低,也再一次證明了正是微生物代謝產物使腸道對共生菌形成了耐受機制。然而,這項研究最有意思的部分在於,發現這種低反應性是有選擇的。腸巨噬細胞仍然可以產生正常水準的TNF-α和MCP-1,保有噬菌和殺菌活性。如果有興趣的話,你可以思考一下,這些基因為什麼通過進化選擇「逃」過了n-丁酸介導的轉錄抑製。在這個問題上,一種很吸引人的假說是,TNF-α和MCP-1能夠促使單核細胞和中性粒細胞向腸組織募集,而這些細胞還未被SCFA所影響,一旦腸道屏障被破壞,就能夠隨時產生促炎因子以應對侵入的細菌。由此導致的炎症環境就可以克服由其他固有和適應性免疫細胞,主要是Treg細胞,營造出的免疫抑製局面了,從而使得在免疫耐受狀態下發生炎症應答有了可能,而這種應答是清除感染、開啟組織修復所必須的。
細菌通過代謝產物與宿主聯繫
Chang等的研究連同最近這幾項分別由日本RIKEN的Atarashi K等、哈佛公共衛生學院的Smith PM等以及紀念斯隆-凱特林癌症中心的Arpaia N等開展的研究,無不突出了細菌代謝產物的多效性——這些代謝物在不同細胞類型的多條信號通路中都有參與,並能使固有和適應性免疫細胞應答不對共生菌群產生威脅。這些研究「翻譯」出了宿主和共生菌之間互相「交流」的化學「語言」,對特定微生物代謝物是如何影響宿主不同類型細胞這一問題給出了答案。而這又給科研人員提供了一個激動人心的研究領域,他們可以繼續探索以破解共生生物間相互溝通的密碼。
參考文獻:Proceedings of the National Academy of the Sciences 2014;111:2058-2059