導語
揭秘癌症基因水準的起始和進展
醫學論壇網腫瘤翻譯整理
TET蛋白:DNA甲基化中的雙重試劑可預防災難性癌症
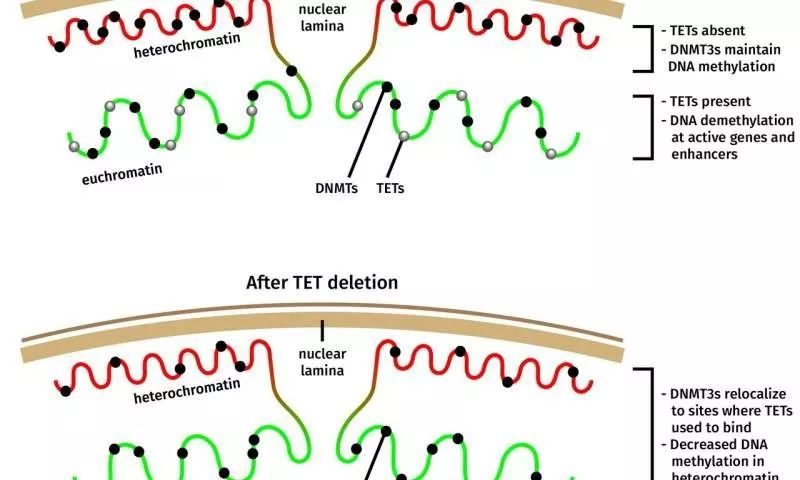

(在TET缺陷細胞中,一部分Dnmt3a分子從異染色質中重新定位,解釋了在該基因組區域中看似矛盾的甲基化損失。圖片來源:La Jolla免疫學研究所Jenna Hambrick)
(Medicalxpress網站7月29日報導)除了DNA字母表中的四個主要鹼基A、C、G和T,還有一個「第五」鹼基,5-甲基胞嘧啶(5mC),它在決定基因和其他DNA打開或關閉中起著不成比例的重要作用。
毫無疑問,胞嘧啶甲基化的缺陷與發育異常、遺傳疾病和癌症有關。
La Jolla免疫學研究所(LJI)的研究人員在《美國國家科學院院刊》的最新研究中揭示了DNA甲基化和去甲基化之間微調平衡如何預防基因組不穩定性和癌症。
雖然科學家們知道被稱為DNMT的酶負責將5mC標記在胞嘧啶上,但這種標記如何被去除仍然是一個謎團。
在一項早期的研究中,本研究的LJI教授和資深作者Anjana Rao博士與劍橋大學、哈佛大學和國立衛生研究院的前同事一起,研究了被稱為TETs的癌症相關蛋白,將5mC轉化為「第六鹼基」5hmC,隨後恢復為C。
此後,很明顯TET功能的喪失與人類和小鼠中的多種癌症密切相關。
儘管預計DNMT和TET具有相反的活性——DNMT產生5mC而TET消除它——具有TET2或DNMT3A突變的血癌患者顯示出相似的特徵,如DNA損傷程度和基因組不穩定性增加。
此外,DNMT3A和TET2是克隆造血中突變的前兩種蛋白質,克隆造血是一種衰老疾病,其中血液乾細胞的某些克隆比其他克隆擴增更多。克隆性造血的人有動脈粥樣硬化和進行性癌症的風險。
Rao實驗室的最新發現解釋了為什麼TETs和DNMTs的突變在疾病中具有相似的作用。
Rao實驗室的研究生、該研究的第一作者IsaacF.López-Moyado分析了TET2和TET3在小鼠T細胞中缺失時出現的侵襲性淋巴瘤的甲基化模式,他發現大區域基因組DNA甲基化增加,符合預期的假設。
然而,與正常的非癌性T細胞相比,這些相同的癌症樣品具有同樣大的基因組區域,其喪失了DNA甲基化。
「這是令人驚訝的,因為過去十年的觀點是TET突變導致DNA甲基化增加,」López-Moyado說。「雖然這對於某些基因組區域來說是正確的,但對於被稱為異染色質的大片基因組而言並非如此。」異染色質是一種緊密堆積的DNA形式,通常是無活性的,通常位於細胞核的外圍。
仔細觀察DETt3a分子在TET缺陷細胞中的分布,發現Dnmt3a分子的一部分已從異染色質中重新定位,這解釋了該基因組區域中甲基化看似矛盾的丟失。
有趣的是,大量白血病患者同時攜帶TET2和DNMT3A突變,並且已知在TET2和DNMT3A中攜帶雙重突變的小鼠比僅具有TET2或DNMT3A突變的小鼠產生更嚴重的癌症。
這一觀察結果促使López-Moyado分析來自小鼠造血乾細胞(血癌細胞)的公開數據,以確定雙重突變是否與異染色質的甲基化狀態改變有關。
López-Moyado發現具有雙重TET2和DNMT3A突變的細胞在異染色質中顯示出比僅具有這些突變之一的細胞更顯著的DNA甲基化損失。
事實上,即使沒有TET或DNMT3A突變,異染色質中DNA甲基化的減少在癌症中也很常見,這表明可能涉及TET或DNMT功能的喪失。
異染色質佔哺乳動物基因組的一半以上,不僅包含需要在任何特定類型細胞中沉默的基因,還包含「寄生」DNA和很久以前侵入基因組的各種「重複」序列。這些DNA,包括轉座子和古老的病毒,需要在異染色質中嚴格抑製。
如果異染色質失去DNA甲基化,這些元素可能會重新激活並形成異常結構或從一個基因組位置跳到另一個基因組位置,導致基因組不穩定和DNA損傷,這是癌症的標誌,」López-Moyado解釋道。實際上,在許多類型的遺傳性和非遺傳性癌症中,通常觀察到這些特徵以及DNA低甲基化,包括具有TET和DNMT3A突變的癌症。
未來的研究將確定異染色質中由DNA甲基化途徑突變引起的DNA甲基化的丟失是否在異染色質再激活和癌症起始和進展中具有直接作用。