4月10日,國家藥品監督管理局藥品審評中心(以下簡稱「葯審中心」)網站擬優先審評公示欄目更新的信息顯示,東莞市陽之康醫藥有限責任公司的苯甲酸阿格列汀片(規格為6.25mg、12.5mg、25mg)、鹽酸二甲雙胍片(規格為500mg、850mg),杭州中美華東製藥有限公司的阿那曲唑片等6個品規有望加入優先審評行列。
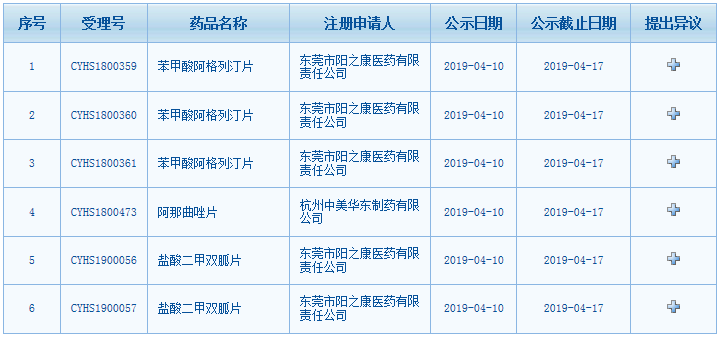

其中苯甲酸阿格列汀片、鹽酸二甲雙胍片均為糖尿病用藥。有數據顯示,我國糖尿病人口數量已經達到1.14億人。
苯甲酸阿格列汀片由日本武田製藥(Takeda Pharmaceutical Company Limited)原研生產,適用於治療II型糖尿病;作為飲食控制和運動的輔助治療,可與鹽酸二甲雙胍聯合使用,在飲食和運動基礎上改善II型糖尿病患者的血糖控制。據了解,近幾年來對糖尿病藥物的研發進展較為緩慢,我國及全球對糖尿病領域藥物靶點的關注仍然集中於GLP-1受體激動劑、DPP-4抑製劑和SGLT-2抑製劑領域。苯甲酸阿格列汀片是一種高度選擇性的DPP-4抑製劑,是我國批準的第5個DPP-4抑製劑。目前已有超過40家本土製葯企業的苯甲酸阿格列汀片已進入到上市申請階段。
鹽酸二甲雙胍片也是II型糖尿病治療葯,用於單純飲食控制不滿意的II型糖尿病病人,尤其是肥胖和伴高胰島素血症者。2017版中國2型糖尿病防治指南推薦二甲雙胍為糖尿病治療的首選和全程用藥,是所有聯合治療方案的基礎用藥。目前國內已有北京四環製藥、華南葯業、天安葯業等多家企業生產的鹽酸二甲雙胍片通過仿製葯一致性評價。
國家葯監部門在2017年底發布的《關於鼓勵藥品創新實行優先審評審批的意見》明確,具有明顯臨床價值,符合在中國境內用同一生產線生產並在美國、歐盟藥品審批機構同步申請上市,且通過了其現場檢查的藥品註冊申請可以申報優先審評審批。本次申報的三個品規的苯甲酸阿格列汀片和兩個品規的鹽酸二甲雙胍片,均是按「同一生產線生產」納入擬優先審評通道,其同產品已分別於2019年和2018年在美國上市。
阿那曲唑片是一種抗腫瘤用藥,適用於絕經後婦女晚期乳腺癌的治療以及絕經後婦女激素受體陽性的早期乳腺癌輔助治療。公示信息顯示,該申請為「列入《關於開展藥物臨床試驗數據自查核查工作的公告》(國家食品藥品監督管理總局公告2015年第117號)的自查核查項目,申請人主動撤回並改為按與原研葯質量和療效一致的標準完善後重新申報的仿製葯註冊申請」,因此擬納入優先審評程序。


更多精彩,盡在中國食品藥品網。









