
好消息:
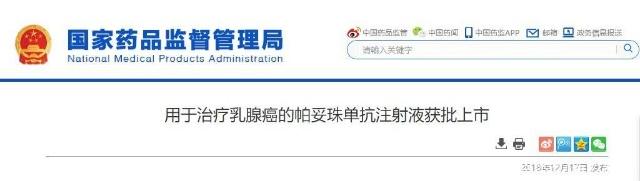
國家葯監局網站17日消息,近日,國家藥品監督管理局批準帕妥珠單抗注射液(英文名:Pertuzumab Injection)進口註冊申請,聯合曲妥珠單抗和化療用於具有高複發風險的人表皮生長因子受體2(HER2)陽性早期乳腺癌患者的輔助治療。
乳腺癌是女性發病率最高的惡性腫瘤。HER2陽性的早期乳腺癌患者接受赫賽汀聯合化療後,仍有約1/4的患者在10-11年後出現疾病複發或死亡,高危早期乳腺癌患者出現複發或死亡的比例更高。
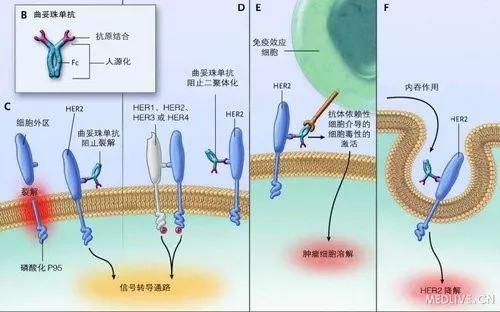
帕妥珠單抗注射液為羅氏公司研發的一種新型抗HER2藥物,通過抑製HER2異源性和同源性二聚體產生抗HER2作用。全球關鍵III期輔助治療研究顯示,與當前標準治療曲妥珠單抗聯合化療相比,帕妥珠單抗聯合曲妥珠單抗和化療用於具有高複發風險的HER2陽性早期乳腺癌患者輔助治療,顯著改善了患者無侵襲性疾病生存期,不良反應可控。
鑒於本品臨床效益/風險優勢明顯,12月17日,國家藥品監督管理局批準本品進口註冊,與曲妥珠單抗和化療聯合用於具有高複發風險的HER2陽性早期乳腺癌患者的輔助治療。帕妥珠單抗的獲批上市無疑給中國乳腺癌患者提供了更豐富的治療選擇。這也意味中國HER-2陽性乳腺癌患者的治療基本與世界同步!
新葯上市,大家在高興之餘更關注的還是價格問題。雖然目前帕妥珠單抗還沒有公布定價,但價格想必也不會太低。面對新葯,昂貴的費用讓很多患者望而卻步。我們只能盼望它早日進入醫保,讓更多的患者能用的起葯。


HER-2陽性乳腺癌患者的臨床試驗招募
乳腺癌患者除了購買藥物治療之外,還可以通過臨床招募的方式,參與到正規、嚴謹的臨床試驗來接受藥物治療,這樣不但可以讓患者免費接受治療,而且還可以提前接受最新的治療方法。以下為募海棠為HER-2陽性晚期乳腺癌患者推薦的一項臨床試驗招募項目(已通過國家食品藥品監督管理局批準(批件號:2013L01513))。對於滿足條件的患者可以報名參加。
項目名稱:
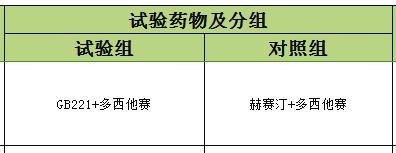
比較GB221聯合多西他賽和曲妥珠單抗聯合多西他賽一線治療HER2陽性的轉移性乳腺癌患者的有效性、安全性的III期臨床試驗
對照藥物為:赫賽汀。
治療方案:
參加本研究,有機會獲得A、B方案治療:
A:注射用重組抗HER-2(表皮生長因子受體2)人源化單克隆抗體(簡稱GB221)聯合多西他賽。GB221是針對HER-2(表皮生長因子受體2)受體的乳腺癌分子靶向治療藥物,臨床前研究證實,GB221與已上市同類藥物赫賽汀在蛋白結構、理化特性和凍融穩定性方面具有相似性,具有明顯的體內外抗腫瘤作用,安全性良好。 多西他賽是治療晚期乳腺癌的經典化療藥物;
B:赫賽汀聯合多西他賽
註:參加本研究,獲得A方案或者B方案的治療概率各50%
主要參加條件:
1. 年齡滿18周歲的女性患者;
2. 經病理學或組織學診斷為晚期乳腺癌,且至少有一個可測量的靶病灶,CT掃描(電腦斷層掃描)≥10 毫米;
3. HER-2(人類表皮生長因子受體2)陽性;
4. 目前不適合手術/放療;
5. 既往未接受過針對晚期乳腺癌的全身性治療;
6. 紫杉類藥物治療停止已至少6個月;
提示:以上為主要參加標準,最終入組情況以項目醫生為準。
報名本項目或者想了解更多乳腺癌臨床招募項目,關注微信公眾號「募海棠」。