Nivolumab(O葯)新輔助治療非小細胞肺癌(NSCLC)的研究結果發表在2018年4月16日新英格蘭雜誌上,研究結果顯示,O葯新輔助治療毒副反應小,並不延遲手術時間,45%患者達到了主要病理緩解。根據CheckMate-214的研究數據,FDA於2018年4月批準了nivolumab和ipilimumab聯合使用作為晚期RCC中危和低風險患者的一線治療。
目前,一項比較Nivolumab+Ipilimumab或Nivolumab+含鉑雙葯化療與含鉑雙葯化療治療早期NSCLC的隨機、開放性、3期試驗。以下是該臨床試驗的相關資訊,有意向的癌症患者可以聯繫全球腫瘤醫生網的醫學顧問(文末有醫學顧問的聯繫方式)。
試驗目的在可手術的IB期(≥4 cm)、II期或可切除的IIIA期(N2)PD-L1+(≥1%)NSCLC參與者中,通過盲態獨立中心審查(BICR),與含鉑雙葯化療相比較,評估應用nivolumab+ ipilimumab或nivolumab+含鉑雙葯化療參與者的無事件生存期和病理學完全緩解率。
試驗葯資訊
Nivolumab與Ipilimumab簡介
Opdivo,即Nivolumab,納武單抗,商品名:歐狄沃,簡稱O葯。O葯是PD-1(程式性死亡受體-1)抑製劑。PD-1抑製劑通過阻斷腫瘤細胞和T細胞間的PD-1/PD-L1信號通路,部分恢復T細胞功能,重新激活患者自身的免疫細胞來殺死腫瘤細胞,是一種全新的抗腫瘤治療理念。與傳統療法相比,PD-1抑製劑所代表的免疫療法最大的優勢在於免疫系統具有記憶功能,一旦起效,療效具有持久性,因此可以帶來較長的生存獲益,甚至臨床治癒。
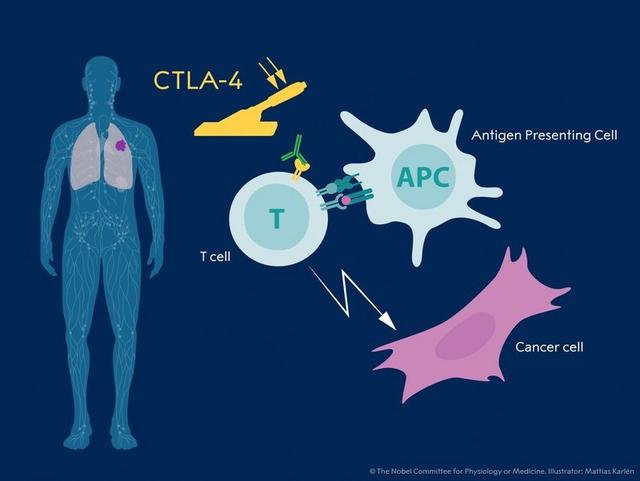
Ipilimumab,即伊匹單抗,商品名 YERVOY, 由是由美國百時施貴寶研製,於2011年3月25日獲FDA批準上市,用於治療不可切除的或轉移性黑色素瘤,它是一種單克隆抗體,能結合細胞毒性T淋巴細胞相關抗原(CTLA-4),阻止CTLA-4與其配體(CD80和CD86)的結合,而阻斷CTLA-4可以增加T細胞的活性和增殖能力。
試驗設計
主要終點指標及評價時間入選標準
a) ECOG評分 0-1;
b)組織學證實的 IB期(≥ 4 cm)、 II期、IIIA期(N2) NSCLC有認為可切除的疾病;
c) 按實體瘤療效評價標準版本 1.1,有可測量的病灶;
d) 有腫瘤組織樣本可用於 PD-L1免疫組織化學檢查: i) 在隨機化前提交福爾馬林固定、石蠟包埋(FFPE)的組織塊或未染色的腫瘤組織切片以及相應的病理學報告,供生物標誌物評價。腫瘤組織樣本必須是新鮮的或是在入組前3個月內獲得的存檔樣本。 ii) 組織必須是空心針穿刺活檢、切除或切開的活檢標本。EBUS法獲取的細針穿刺活檢不足以作為生物標誌物審查和隨機依據。EBUS法獲取的空心針穿刺活檢可作為隨機依據;
e )所有的可疑縱隔淋巴結(包括病理性增大或PET/CT上FDG濃聚的淋巴結, 如果可通過EBUS、胸腔鏡或縱膈鏡進行檢查,需要進一步採樣用於病理學確認。
排除標準
a) 存在局部晚期不可切除的或轉移性疾病;
b) 有已知 EGFR突變或 ALK易位的參與者。如果進行檢測,應使用 FDA批準的檢測方法;
c )排除腦轉移參與者 ,有 II期或 II期以上疾病的所有參與者和懷疑腦轉移的參與者應在隨機前28天內進行腦部 MRI或 CT檢查;
d) 有≥2級周圍神經病變;
e) 患有活動性、已知或疑似自身免疫性疾病的參與者;
f) 已知有人類免疫缺陷病毒(HIV)檢驗陽性病史或已知有獲得性免疫缺陷綜合征(AIDS)。
招募人數共招募642人, 中國招募208人。
中國臨床參加機構(醫院)01 天津腫瘤醫院
02 中國人民解放軍總醫院
03 西安交通大學第一附屬醫院
04 復旦大學附屬中山醫院
05 北京腫瘤醫院
06 北京協和醫院
07 上海胸科醫院
08 南昌大學第一附屬醫院
09 湖南省腫瘤醫院
10 遼寧省腫瘤醫院
11 四川大學華西醫院
12 南昌大學第二附屬醫院
13 唐都醫院
14 浙江省腫瘤醫院
15 浙江大學醫學院附屬邵逸夫醫院
16 吉林省腫瘤醫院
17 福建省腫瘤醫院
18 浙江大學醫學院附屬第一醫院
19 廣州醫科大學附屬腫瘤醫院
20 中南大學湘雅醫院
申請方式申請電話:400-666-7998
負責人:全球腫瘤醫生網醫學部
如果您有意參加臨床試驗,或想了解更多資訊,也可添加腫瘤專業醫學顧問微信,為您做臨床招募入組的初篩,以確定您是否符合方案規定的入選標準。