慢性乙型肝炎長期抗病毒治療中的藥物安全是臨床關注的首要問題。剛剛在我國獲批的富馬酸丙酚替諾福韋(TAF)的一大優勢就是靶向肝臟,從而大幅改善了對腎臟和骨骼的安全性,進一步增加了長期用藥的安全係數。不過藥物安全並不只需要考慮腎臟,TAF的其他安全性特徵如何?在妊娠、老年人、兒童、肝功能嚴重損害等特殊人群中如何應用TAF?希望本文能為這個問題的答案提供一些資訊。
整體安全性及不良反應
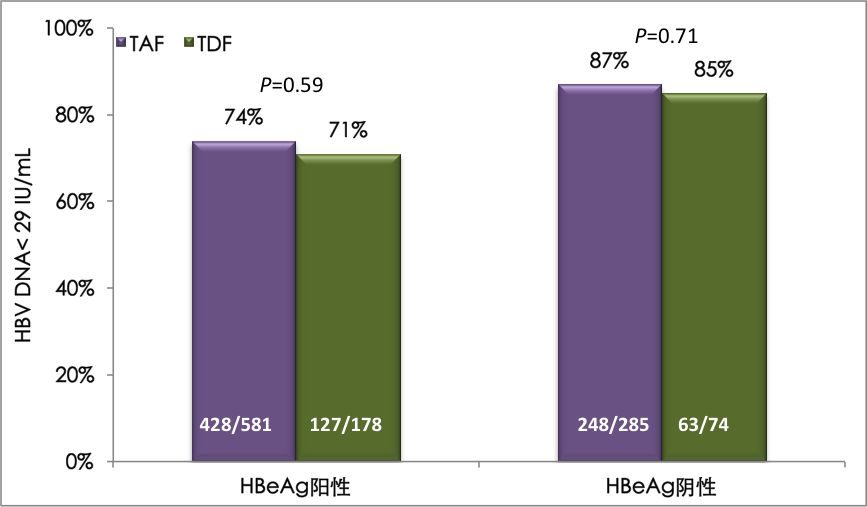
既往TAF全球III期臨床研究96周的數據[1]顯示,TAF治療慢B肝的整體安全性和耐受性好,絕大部分不良事件為輕~中度,最常報告的不良反應為頭痛(12%)、噁心(6%)和疲勞(6%)。在第69屆美國肝病學會(AASLD)年會上公布的144周結果與之相似[2]。TAF在中國大陸患者中的安全性特徵(96周數據)與全球試驗中所觀察到的安全性特徵基本一致,且未見因不良事件停葯[3,4]。FDA黑框警告變更
2016年11月,TAF剛剛在美國獲FDA批準上市時,FDA在其產品標籤中加入了一個黑框警告,提醒警惕:①停葯後乙型肝炎急性嚴重發作;②伴脂肪變性的嚴重肝腫大;③乳酸性酸中毒風險[5]。其中,乳酸性酸中毒和伴脂肪變性的嚴重肝腫大在應用TDF的患者中均有報導[6],包括致死性病例。但後來FDA取消了有關這二者的黑框警告,改為建議當應用TAF治療的患者出現提示乳酸酸中毒的臨床癥狀或顯著肝臟重大時立即停葯並就醫[7]。
妊娠安全
過去,關於藥物的妊娠安全性,大家一直沿用ABCDX的分級標準,簡單來說,X類藥物為妊娠和計劃妊娠婦女禁用(例如干擾素),而A類和B類藥物可以用於妊娠婦女。在口服NA中,TAF和TDF均為B類藥物,替比夫定為B類,其他所有核苷類似物物均為C類。
不過這個啟用於1979年的分級系統,由於過於簡單,不能反映有效的可用資訊,未能有效傳遞妊娠期、哺乳期及潛在備孕男女的用藥風險,令醫療決策者感到困惑,且會導致錯誤的用藥處方等原因,被FDA宣布廢棄。新的妊娠/哺乳期用藥規則[8]要求藥物說明書中納入更多針對孕婦、胎兒及哺乳期嬰兒的有效資訊,包括藥物是否泌入乳汁、是否影響嬰兒等,並且加入「備孕男性與女性」條目,標註藥物對妊娠測試、避孕及生育的影響的相關資訊。就TAF而言,對於孕婦應用TAF後是否存在藥物相關的不良胎兒發育結局風險,目前尚無人類數據可提供資訊。但在兔和大鼠的研究中,在器官形成階段暴露於51倍或等同於人體推薦劑量的TAF的幼崽其發育並未見受到不利影響[7]。另外,大量孕婦應用TDF的數據顯示,未發現與TDF有關的畸形或胎兒/新生兒毒性--而應用TDF時人體的替諾福韋(TFV)暴露量是應用標準劑量TAF時的約12倍[7]。鑒於此,我國TAF的說明書中建議,如有必要,可考慮在妊娠期間使用TAF[9]。另外,由於替諾福韋可分泌至乳汁中,當前資訊不充分,不能排除相關潛在風險,故哺乳期間不應使用TAF。肝腎功能不全人群
輕、中、重度腎損害患者均無需調整TAF劑量。具體而言,對於肌酐清除率(CrCl)估計值≥15 mL/min,或CrCl<15 mL/min但在接受血透的患者,無需調整TAF劑量。在CrCl<15 mL/min但未接受血透的患者中,TAF的葯代動力學尚未得到研究,尚無給藥劑量推薦[9]。無需針對肝功能損害患者調整TAF劑量。不過,由於TAF在失代償性肝病以及Child-Pugh評分>9(C級)的患者中的安全性和療效尚無數據,這些患者出現嚴重肝臟或腎臟不良反應的風險可能更高。因此,應嚴密監測患者的肝腎功能相關指標[9]。老年人和兒童
在年齡為65歲及以上的患者中,無需調整TAF劑量。TAF目前已被批準治療12歲以上(或體重>35 kg)的兒童和青少年,TAF在12歲以下或體重<35 kg的兒童中的安全性和療效尚未確定,目前不推薦應用[9]。
總結
總之,由於TAF對肝臟具有更好的靶向性,降低了TAF在外周的暴露,使其用量更小、安全性得到提升。目前TAF已經在包括我國大陸在內的多個國家和地區獲批用於治療慢性乙型肝炎。我們期待有更多上市後的安全性數據公布,完善TAF在不同人群中的應用資料,指導臨床的安全用藥。
參考文獻
1.Agarwal K, Brunetto M, Seto WK, et al. 96?weeks treatment of tenofovir alafenamide vs. tenofovir disoproxil fumarate for hepatitis B virus infection. J Hepatol. 2018 Apr;68(4):672-681.
2.Chan HL, Lim YS, Seto WK, et al. Three Year Efficacy and Safety of Tenofovir Alafenamide (TAF) Compared to Tenofovir Disoproxil Fumarate (TDF) in Hbeag-Negative and Hbeag-Positive Patients with Chronic Hepatitis B. AASLD2018 Poster 381.
3.Ning Q, Duan ZP, Chen Y, et al. A Phase 3 Study Comparing Tenofovir Alafenamide With Tenofovir Disoproxil Fumarate in Patients From China With HBeAg-Negative, Chronic Hepatitis B: Efficacy and Safety Results at Week 48. APASL2018. O-HBV-12.
4.Hou JL, Zhang LL, Duan ZP, et al. A Phase 3 Study Comparing Tenofovir Alafenamide With Tenofovir Disoproxil Fumarate in Patients From China With HBeAg-Positive, Chronic Hepatitis B: Efficacy and Safety Results at Week 48. APASL2018. HBV-C82
5.Gilead Sciences. Prescribing information: VEMLIDY?(tenofovir alafenamide).version 20166.Gilead Sciences. Prescribing information: VIREAD?(tenofovir disoproxil fumarate). https://www.gilead.com/~/media/files/pdfs/medicines/liver-disease/viread/viread_pi.pdf?la=en7.Gilead Sciences. Prescribing information: VEMLIDY?(tenofovir alafenamide). <https://www.gilead.com/~/media/files/pdfs/medicines/liver-disease/vemlidy/vemlidy_pi.pdf?la=en>8.FDA. Pregnancy and Lactation Labeling (Drugs) Final Rule. https://s3.amazonaws.com/public-inspection.federalregister.gov/2014-28241.pdf
9.富馬酸丙酚替諾福韋片產品說明書.2018版