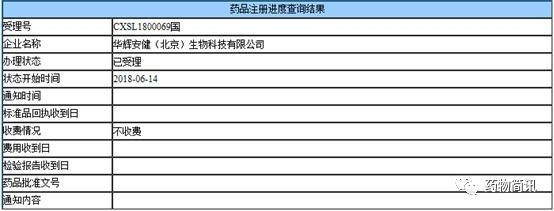
在B肝藥物開發領域,一種B肝病毒(HBV)進入抑製劑Myrcludex B或bulevirtide已經進入第3期臨床試驗。這種研究藥物利用的是,NTCP底物,包括牛磺膽酸及其衍生物,在發現NTCP作為HBV/HDV受體後立即進行檢測(下圖:來自MYR Pharma公司簡介Bulevirtide:它是一種治療慢性B肝和慢性丁肝新型候選藥物,最初由Stephan Urban教授(德國海德堡大學)開發)。

B肝進入抑製劑匯總,2種CsA衍生物,1種滅活NTCP受體
6月18日發表在Cells上,由法國圖爾大學3名研究人員介紹,研究結果表明,高濃度結合膽鹽能有效抑製HBV/HDV感染。然而,抑製感染所需的濃度,遠遠高於人體內膽汁鹽濃度的正常生理範圍,若選擇使用這種藥物延長治療時間,可能將導致不良反應。除了內源性底物外,外源性物質也可以通過NTCP進行轉運。事實上,主要膽固醇轉運體NPC1L1的抑製劑ezetimibe也是NTCP的底物,並被證明可以干擾HBV/HDV的進入。
和底物抑製劑不同,一些肽底物與NTCP結合而不被轉運到細胞中。HBV-preS1和環孢霉素A(CsA)的肽正屬於這一類。目前,慢性B肝藥物開發進展方面,B肝在研新藥Myrcludex B或bulevirtide(HBV進入抑製劑),它是一種從HBV L蛋白的前S1結構域衍生的十四烷基化47氨基酸合成肽,目前正在進入第3期臨床試驗,並已證明能有效地抑製HBV/HDV感染(來自法國圖爾大學研究人員原文點評,發表Cells)。

CsA是一種被批準用於免疫抑製藥物,對HBV具有抗病毒活性。然而,在長期跟蹤隨訪期間,研究人員觀察到這類抑製劑會干擾膽汁酸攝取,可能導致不良反應。CsA衍生物在不影響膽汁酸轉運的情況下,抑製HBV進入的能力已經被科學研究發現,以避免這些問題!目前,有2種CsA衍生物,分別是SCY450和SCY995,已被證明能夠在不干擾膽汁酸攝取情況下,引起強烈的B肝病毒抑製。
然而,在這些CsA衍生物被評估為人類治療的進入抑製劑前,還需要在動物模型中,進行安全性和有效性詳細研究。從掌握醫藥技術情報來看,HBV進入抑製劑Myrcludex B是目前唯一進入第3期臨床試驗的抑製劑。Myrcludex B,已被證明在比抑製膽汁酸攝取所需濃度低50倍的濃度下,抑製HBV/HDV進入。因此,Myrcludex B可用於滅活NTCP的受體功能,其劑量不會顯著影響其作為膽鹽轉運體的自然功能,如CsA所示。

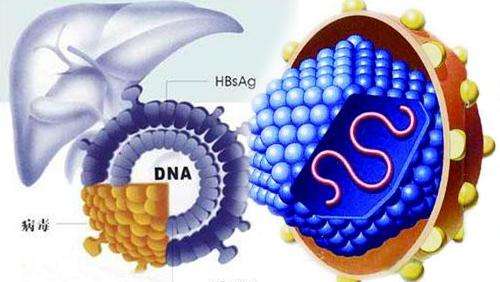
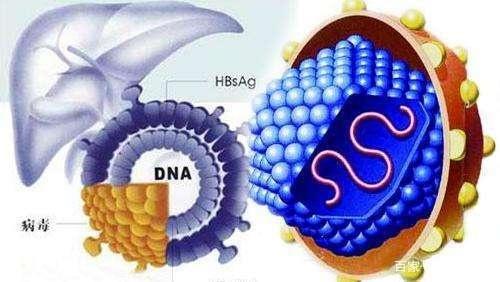
根據法國圖爾大學的Charline Herrscher、Philippe Roingeard、Emmanuelle Blanchard發表在Cells報告看,NTCP作為HBV和HDV的特異性進入受體鑒定,無疑是目前藥物學家的一項重大突破!研究人員介紹,該靶點極大地促進了我們對HBV生命周期的認識。B肝病毒,已被證明在與自身受體NTCP及其共受體EGFR相互作用前,與高硫酸化HSPGs(如glypican 5)結合,後者優先在肝髒中表達。
研究發現,E-cadherin在HBV感染中起著重要作用,通過將NTCP作用於質膜。一旦與NTCP-EGFR結合,HBV通過網格蛋白介導的內吞作用,被內化並到達內體室。內質體融合似乎發生在晚期的內質體中,但觸發內質體融合的線索,目前還尚未明確。與感染性顆粒物相比,B肝病毒已被證明產生大量的SVP。大量分泌SVP的目的及這些顆粒在B肝病毒生命周期中的相關性仍然不清楚。

目前,科學界普遍認為,SVP可能在免疫系統逃避中起作用。有趣的是,SVP可以結合肝細胞,但尚不清楚它們是否可以被內化,以及這些存在缺陷的顆粒是否遵循與HBV病毒離子攝取相關的內吞機制!從HBV病毒進入抑製劑開發角度看,如果上述邏輯被完全證明,那麽澄清這些粒子作用就很重要。與此同時,科學界對HBV進入分子機制的深入了解,也會推動新的HBV進入抑製劑開發,使從感染的肝細胞中,根除HBV成為可能( 上圖來自Cells,為法國圖爾大學研究人員整理的基於HBV進入抑製劑開發B肝新藥的名稱、數量及最新進展,Myrcludex B也是目前唯一進入第3期研究藥物,截止2020年6月)。返回搜狐,查看更多
責任編輯: