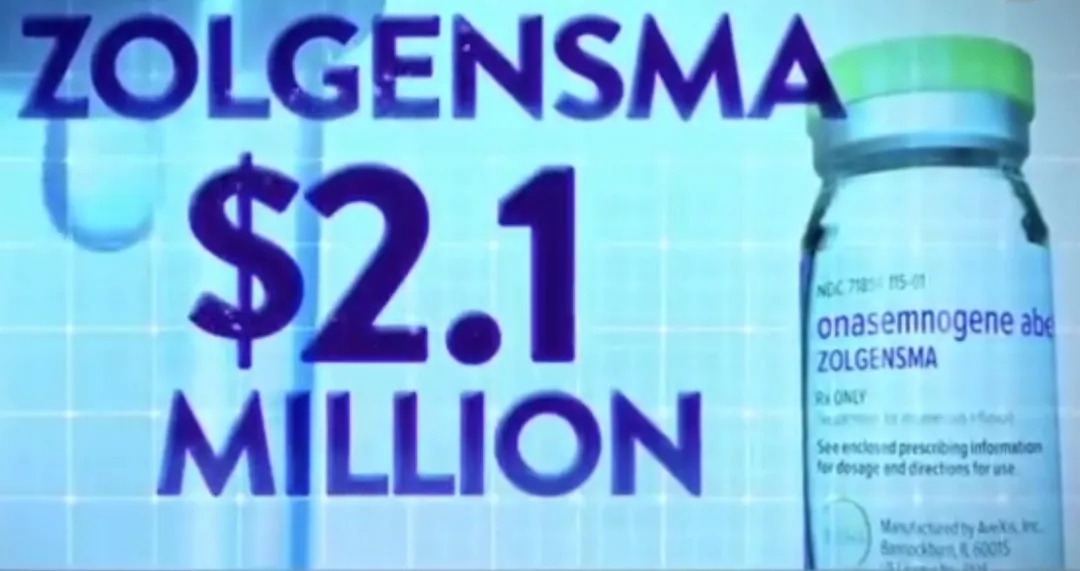新京報訊(記者張秀蘭)隨著新藥審批的提速,進口藥上市步伐不斷加快,國內創新藥物也不斷湧現。數據顯示,截至2018年12月,排隊等待審評的藥品注冊申請已由2015年高峰時的近2.2萬件降至3000件以下。根據新京報記者統計,進入2019年以來,已經有10個藥品在國內上市或獲批新適應症。
更值得期待的是,還有百濟神州的替雷利珠單抗等藥物,有望短期內獲批上市。
今年以來國內獲批上市了10種藥物
1 藥物:歐雙靜(通用名:二甲雙胍恩格列淨片)
企業:勃林格殷格翰
獲批(上市)時間:2019年2月
適應症:成人2型糖尿病
歐雙靜是由恩格列淨和鹽酸二甲雙胍組成的單片複方製劑,用於適合接受恩格列淨和鹽酸二甲雙胍治療的2型糖尿病成人患者,歐雙靜是一種簡便的複方單片劑藥物,兩種降糖成分機制互補,可提供更強效和持久的血糖控制,且能夠減少患者服藥片數,從而增加患者的依從性,而依從性的提高也有助於進一步改善血糖控制。
2 藥物:欣煒歌(通用名:他達拉非片)
企業:長春海悅
獲批(上市)時間:2019年2月
適應症:男性勃起功能障礙
數據顯示,國內目前僅有兩家企業的他達拉非片劑獲批上市,即禮來製藥的希愛力和長春海悅藥業今年剛剛獲批的他達拉非片,這也意味著,長春海悅成為國內首個獲得本品仿製藥上市的企業。目前在研廠家多達27家,包括華海藥業、華潤賽科、齊魯製藥等,截止到長春海悅的藥品獲批時,20家已獲批臨床試驗,9家正處於臨床試驗中,5家提交上市申請中,有三家不予批準。
3 藥物:令澤舒 (通用名:利那洛肽)
企業:阿斯利康
獲批(上市)時間:2019年1月
適應症:成人便秘型腸易激綜合征(IBS-C)
便秘型腸易激綜合征(IBS-C)是一種反覆發作,以便秘為主要特徵並伴隨腹痛、腹脹和腹部不適的功能性腸病,嚴重影響工作和生活質量,在我國至少有1400萬患者飽受困擾。我國IBS-C患者的確診率普遍較低,即使確診,由於缺乏專門針對IBS-C的治療藥物,只能選擇一些替代藥物達到短期緩解症狀的目的。令澤舒為全球首個鳥苷酸環化酶激動劑,其創新機制是通過激活人體一種自有的鳥苷酸環化酶,促使腸液分泌,並通過降低內髒高敏感,達到同時緩解便秘型腸易激綜合征患者腹痛、腹脹和便秘等症狀的效果。與安慰劑比較,六成以上的患者在使用一天后就能夠實現自主排便;一周內,患者的嚴重腹痛症狀及完全自主排便頻次均獲得顯著改善;近九成的患者在整個治療周期內,自主排便次數顯著增加,近八成的患者腹痛、腹脹顯著改善。
4 藥物:羅舒達 (通用名:鹽酸魯拉西酮片)
企業:住友製藥
獲批(上市)時間:2019年1月
適應症:精神分裂症
羅舒達是一種日服一次的非典型抗精神病藥物,其活性藥物成分為lurasidone(魯拉西酮),與其他現有的抗精神分裂症藥物相比,魯拉西酮具有獨特的化學結構,據信對多巴胺D2、5-羥色胺(5-HT2A)、5-羥色胺(5-HT7)受體均具有親和力,在這些受體中具有拮抗作用。此外,魯拉西酮對5-羥色胺(5-HT1A)受體具有部分激動作用,對組胺H1或毒蕈鹼M1受體無明顯的親和力。
5 藥物:Keytruda (簡稱K藥,通用名:帕博利珠單抗)
企業:默沙東
獲批(上市)時間:2019年3月
適應症:表皮生長因子受體(EGFR)基因突變陰性和間變性淋巴瘤激酶(ALK)陰性的轉移性非鱗狀非小細胞肺癌(NSCLC)
由於缺乏有效的早期診斷方法,大多數的肺癌患者在確診時已屬晚期,無法對其進行根治性手術切除且治療手段有限,我國肺癌患者的5年生存率僅為16.1%。此次適應症的獲批,改變了無EGFR或ALK驅動基因突變的晚期非鱗狀非小細胞肺癌患者的生存預期。根據《新英格蘭醫學期刊》上發布的作為此次適應症獲批考量的臨床試驗結果,帕博利珠單抗聯合化療的治療方案相比單純化療治療方案,將患者的相對死亡風險減少了一半,這意味著對於符合條件的NSCLC患者,PD-1 單抗用得越早,生存獲益就可能越大。
6 藥物:度易達(通用名:度拉糖肽)
企業:禮來
獲批(上市)時間:2019年2月
適應症:成人2型糖尿病
雖然臨床上已經有多種治療糖尿病的藥物,但仍需要強效、使用簡便而又安全的藥物來幫助患者更輕鬆地使血糖得到長期平穩的控制,盡可能減少每日給藥次數,降低糖尿病患者用藥負擔,已經成為當前臨床工作者解決血糖達標率低的重要考慮因素。度易達不僅有很好的降糖療效和安全性,而且一周一次使用簡便,有利於患者堅持長期治療。它在幫助患者實現更好的血糖控制的同時,還能改善體重、血脂等多個心血管疾病的危險因素。
7 藥物:瑞百安(通用名:依洛尤單抗,evolocumab)
企業:安進
獲批(上市)時間:2019年1月
適應症:成人動脈粥樣硬化性心血管病(ASCVD)
低密度脂蛋白膽固醇(LDL-C)升高被確認為是心血管疾病(CVD)的重要危險因素,在眾多可乾預的心血管疾病患者的心肌梗死、卒中風險因素中,降低血液中LDL-C水準是重要且有效的手段之一。然而在已接受降脂治療的病患中,相當部分患者的LDL-C水準不能達標。瑞百安(依洛尤單抗)是一款具有開創性的降膽固醇藥物,其可通過抑製前蛋白轉化酶枯草溶菌素/Kexin 9型(PCSK9)與低密度脂蛋白(LDL)受體(LDLR)的結合,增加能夠清除血液中LDL的LDLR的數目,可顯著降低心血管疾病患者LDL-C水準,從而降低心肌梗死和卒中風險,其也成為中國首個獲批用於降低心血管事件風險的PCSK9抑製劑。
8 藥物:利必通分散片(化學名:拉莫三嗪分散片)
企業:葛蘭素史克
獲批(上市)時間:2019年1月
適應症:2歲以上兒童、成人及老人癲癇
利必通分散片作為利必通普通片的升級,具有癲癇治療適應症廣、規格多樣、起始加量更準確等特點,其黑醋栗香(黑加侖)口味口感較好,患者更容易接受,適用於更全年齡段的患者,2歲以上兒童、成人及老人癲癇患者均可服用,並且分散片與普通片之間等量轉換,無須重新測定用藥劑量。利必通作為第二代新型抗癲癇藥物,兼顧療效和安全性,在全球範圍的使用超過28年,累計服用患者數突破1000萬。利必通是英國NICE指南、美國AAN/AES指南、蘇格蘭SIGN指南、中國癲癇臨床診療指南推薦用於治療癲癇局灶性發作和多種全面性發作的一線抗癲癇藥物,大量臨床研究證實,利必通可強效控制局灶性發作和全面性發作,及癲癇綜合征(Lennox-Gastaut綜合征)發作並且具備良好的安全性。
9 藥物:Spinraza(Nusinersen)注射液
企業:Biogen(百健)、昆泰企業管理(上海)有限公司
獲批(上市)時間:2019年2月
適應症:脊髓性肌萎縮症(SMA)
該藥是全球首個獲批治療脊髓性肌萎縮症(SMA)的藥物,也是國家藥監局2018年11月發布的第一批40個臨床急需境外新藥之一。從2018年9月5日上市申請獲受理至2019年2月25日獲批,不到6個月時間。脊髓性肌萎縮症(SMA),又稱進行性脊髓性肌萎縮症、脊肌萎縮症,是一類由脊髓前角運動神經元和腦乾運動神經核變性導致肌無力、肌萎縮的疾病。屬常染色體隱性遺傳病,臨床並不少見。脊髓性肌萎縮症的一個顯著症狀是逐漸惡化的肌無力,對於兩歲以下的嬰幼兒,SMA是頭號的遺傳病殺手,每6000至1萬名新生兒中就有一名會患上SMA。據估算,中國內地約有3萬-5萬名SMA患者。Spinraza是全球首個獲批治療SMA的藥物,也是目前唯一在美國獲批治療脊髓性肌萎縮症的藥物,在美國的上市時間從申請到批準,僅僅用了不到3個月。Spinraza既適用於嬰幼兒,也適用於成人。在一項關鍵對照臨床研究中,與對照組相比,參與Spinraza治療的嬰幼兒患者在運動機能方面獲得了意義深遠的持續性進步。此外,使用Spinraza的患者存活率相對更高。
10 藥物:阿呱沙班
企業:江蘇豪森藥業集團有限公司
獲批(上市)時間:2019年1月
適應症:髖關節或膝關節擇期置換術的成年患者
江蘇豪森藥業集團有限公司的仿製藥阿呱沙班2019年1月被收錄進上市藥品目錄集,這也是全球重磅抗凝血藥物阿呱沙班(艾樂妥)的首仿。值得注意的是,由於原研藥專利保護期尚未到期(專利失效日:2022年9月17日),豪森的阿呱沙班片目前還不能銷售。艾樂妥由百時美施貴寶公司和輝瑞公司聯合研製開發,2011年5月在歐盟首次獲批上市。2012年12月獲美國食品藥品監督管理局(FDA)批準在美國上市;2013年1月獲原國家食品藥品監督管理局批準進入中國,被批準用於髖關節或膝關節擇期置換術的成年患者,預防靜脈血栓栓塞症(VTE),進入了2017版國家醫保目錄。
2019年還有不少值得期待的藥物
藥物:替雷利珠單抗
企業:百濟神州
適應症:霍奇金淋巴瘤
雖然PD-1藥物市場競爭已經日益加劇,但不少企業仍欲入局。替雷利珠單抗是百濟神州研發的用於治療複發/難治性霍奇金淋巴瘤的藥物。霍奇金淋巴瘤是一種對放、化療較為敏感的腫瘤。此外,替雷利珠單抗的非小細胞肺癌、肝細胞癌和食管鱗狀細胞癌也均處於臨床III期試驗。該藥2018年11月15日已被國家藥監局藥品審評中心(CDE)納入優先審評程序。
藥物:恩莎替尼
企業:貝達藥業
適應症:非小細胞肺癌
肺癌患者中80%-85%屬於非小細胞肺癌,其中ALK陽性非小細胞肺癌是一種比較罕見但非常凶險獨特的肺癌亞型,大多數患者對化療藥物響應不理想,並伴有複發風險高、腦轉移發生率高、預後差等問題。在癌症領域,有“抗癌藥第一股”之稱的貝達藥業新藥研發也在繼續。恩莎替尼是一種新型強效、高選擇性的新一代間變性淋巴瘤激酶(ALK)抑製劑,2019年2月15日已被CDE納入擬優先審評程序。
第二批臨床急需境外新藥公示名單公布
另外,3月28日,國家藥品監督管理局藥品評審中心(CDE)公布了第二批臨床急需境外新藥的公示名單,共包括30個急需境外新藥,其中以罕見病用藥居多,涉及企業方面,輝瑞(治療肺動脈高壓的Revatio)、賽諾菲(治療多發性硬化的Lemtrada)、BMS(治療腎上腺皮質癌的Lysodren)、艾伯維(治療C肝的Maviret)等公司產品在列。列入臨床急需境外新藥名單的品種,企業可在提交相關資料後,直接提出上市申請。CDE已建立專門通道開展審評,對罕見病治療藥品,在受理後3個月內完成技術審評;對其他境外新藥,在受理後6個月內完成技術審評。尚未申報的品種,可隨時提出與CDE進行溝通交流,盡快提出上市申請。2018年11月,48個藥品進入首批臨床急需境外新藥名單,目前已有10余個品種批準上市。
編輯 趙昀 校對 范錦春