本文系生物谷原創編譯,歡迎分享,轉載須授權!
Stemline Therapeutics是一家專註於開發和商業化新型腫瘤治療藥物的生物製藥公司。近日,該公司宣布美國食品和藥物管理局(FDA)已批準Elzonris(tagraxofusp-erzs,SL-401),用於2歲及以上母細胞性漿細胞樣樹突狀細胞腫(BPDCN)兒科患者和成人患者的治療,包括既往未接受治療(初治)和既往已接受治療(經治)的BPDNC患者。值得一提的是,此次批準,使Elzonris成為首個獲批治療BPDCN的藥物,同時也是首個獲得批準的CD123靶向藥物。Stemline公司已計劃在2019年初將Elzonris推向市場。
Elzonris的獲批,是基於在初治和經治BPDCN患者中開展的一項多中心、多隊列、開放標籤、單臂研究(STML-401-0114;NCT02113982)的數據。第一隊列中,13例初治BPDCN患者接受了Elzonris標籤劑量和時間表治療,7例(54%)實現完全緩解或臨床完全緩解(CR/CRc),中位CR/CRc持續時間未達到(範圍:3.9個月-12.2個月)。第2隊列中,15例複發性或難治性BPDCN患者接受了Elzonris治療,1例實現CR緩解,1例實現CRc緩解。
Elzonris臨床研究的首席研究員、美國德克薩斯大學MD安德森癌症中心副教授Naveen Pemmaraju表示,「Elzonris的獲批,是BPDCN患者臨床治療向前邁出的重要一步。CD123在BPDCN和許多其他血液惡性腫瘤中表達,Elzonris是一種CD123靶向療法,該葯的批準將為BPDCN患者提供一種新的護理標準。」
Elzonris臨床研究的首席研究員、哈佛醫學院和達納-法伯癌症研究所助理教授Andrew Lane表示,「Elzonris代表著BPDCN治療史無前例的飛躍,這是一種迄今為止還沒有批準治療方案的侵襲性惡性腫瘤。在臨床研究中,有許多患者接受Elzonris治療後經歷了顯著的緩解,其中一部分患者在緩解後接受了乾細胞移植。」
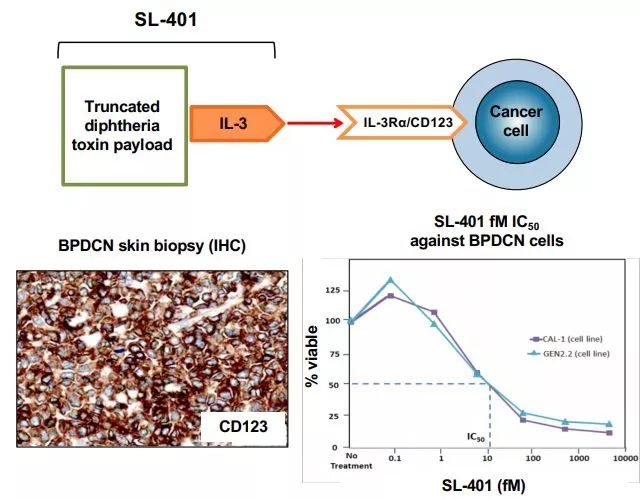
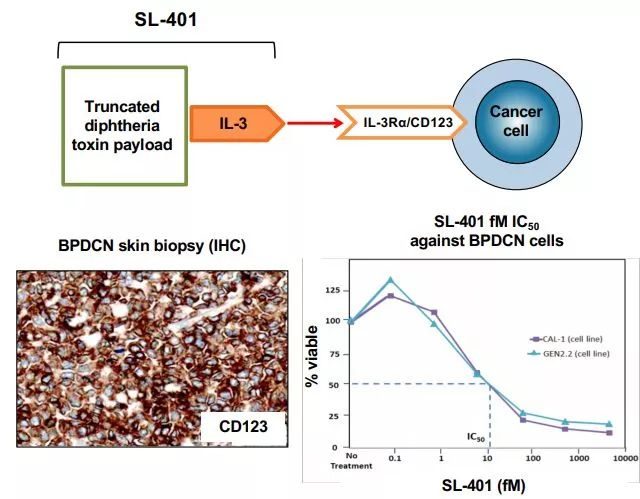
Elzonris(tagraxofusp)的作用機制(圖片來源,Stemline公司網站)
BPDCN是一種侵襲性、罕見性血液系統惡性腫瘤,預後不佳,這是一個醫療需求未滿足的治療領域。BPDCN的特徵可能與某些疾病相似,也可能被誤診為某些疾病,包括急性髓性白血病(AML)、非霍奇金淋巴瘤(NHL)、急性淋巴細胞白血病(ALL)、骨髓增生異常綜合症、慢性粒細胞性白血病(CML)以及其他具有皮膚表現的惡性腫瘤。BPDCN通常存在於骨髓和/或皮膚,也可能涉及淋巴結和內臟。BPDCN的診斷基於CD123、CD4、CD56的免疫診斷三聯體。CD123(IL-3R)是識別BPDCN的一個關鍵標誌物,並且是各種癌症治療研究中的一個迅速出現的靶點。
Elzonris是一種CD123導向的細胞毒素,專門針對CD123靶點設計,該葯由人IL-3與截短的白喉毒素(DT)進行重組融合而成,IL-3結構域能夠將細胞毒性DT片段引導至表達CD123的腫瘤細胞。在被腫瘤細胞內化後,Elzonris能夠不可逆地抑製蛋白質合成並誘導靶細胞凋亡。
在美國,Elzonris已被授予突破性藥物資格(BTD)、孤兒葯資格(ODD),同時通過FDA的優先審查程式進行了審批。在歐盟,Elzonris已被授予加速審批,預計將在2019年第一季度獲得批準。目前,Stemline公司也正在評估Elzonris治療其他適應症,包括慢性骨髓單核細胞性白血病(CMML)、骨髓纖維化(MF)及其他適應症。
參考資料: