篩選靶點十分繁瑣嚴格,HBV進入抑製劑是目前開發慢性B肝新藥方向之一。眾所周知,病毒會與多種宿主相互作用以啟動進入。例如,C肝病毒能與至少14種宿主細胞因子相互作用,以確保有效的細胞感染。但目前科學家對於B肝病毒進入所需的共受體和宿主細胞因子尚未完全闡明。已知被發現的是NTCP對B肝病毒有效感染是必要的,但還不夠。
B肝篩選靶點,宿主細胞參與HBV內化,受體結合介導內吞作用
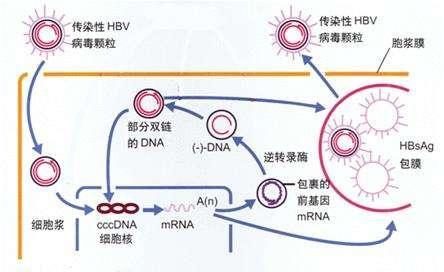
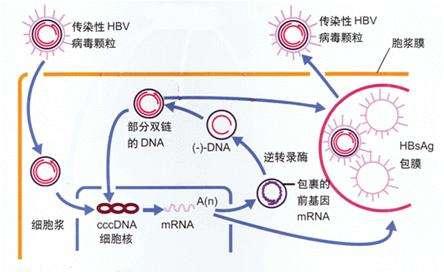
B肝病毒進入需要通過NTCP與肝細胞結合後,才能夠進入細胞,這一發現揭示了宿主細胞因子參與B肝病毒內化過程。法國圖爾大學研究人員認為,這種B肝病毒進入被認為是通過內吞作用發生的。然而,NTCP介導B肝病毒進入的詳細機制仍有待確定,目前還不清楚B肝病毒在細胞滲透過程中,是否與其他受體相互作用。
法國研究人員發現,實際上,在過度表達NTCP細胞系匯總,感染效率仍然相對較低。這些觀察結果表明,可能通過形成複雜的、多步驟的進入過程,對B肝病毒感染的易感性需要額外的宿主因子。在最近的一項研究確定表皮生長因子受體(EGFR)是一種啟動B肝病毒內化宿主進入輔助因子。與這一發現相一致,HepG2細胞系的EGFR水準明顯低於其他肝細胞系,這可能是其低感染率的原因。

在另一項研究中顯示,在B肝病毒進入時,宿主細胞蛋白E-鈣粘蛋白是一種鈣依賴性細胞粘附蛋白。E-cadherin通過影響NCTP的分布,在B肝病毒進入過程中起著重要作用。事實上,這種蛋白質與糖基化的NTCP結合並促進NTCP重新定位到基底外側質膜。細胞極化,被描述為B肝病毒產生性進入的一種強製性機制。
由於細胞極化誘導細胞-細胞粘附蛋白(如E-cadherin)的重新定位到質膜上,這一觀察結果,可部分解釋為E-cadherin對B肝病毒攝取的重要性。有趣的是,與此相反,細胞極化限制了C肝病毒通過緊密連接的進入,形成物理屏障並限制病毒進入受體。目前看來,B肝病毒進入細胞是一種開發B肝新藥的重要靶點,基於科學家對該方面的更多探索,有必要詳細介紹一下,關於受體結合介導的內吞作用。

這個學術名稱雖然聽起來十分難懂,實際上,上述機制指的就是一旦與受體和輔助受體相互作用,B肝病毒就會進入細胞。自從發現NTCP以來,這一步驟所涉及的機制變得更加清楚。已證明肝小窩中的ARG-21介導的感染途徑,可遵循HBV-21介導的進入途徑。然而,2020年6月Cells上這項法國圖爾大學研究人員發表的研究觀點卻指出,先前的一項報告說,用小窩介導的內吞作用的化學抑製劑治療原發性Tupaia肝細胞(PTH)不會損害B肝病毒感染。
一些研究報告了相互矛盾的結果,支持使用網格蛋白介導的內吞作用(CME)HBV進入細胞。事實上,HBV包膜蛋白的preS1結構域,在進入永生化的人原代肝細胞時與網格蛋白和蛋白適配器2(AP-2)相互作用。這一結果通過沉默網格蛋白重鏈(CHC)和AP-2而得到證實。HBV進入的後續步驟的基本機制,最近才在NTCP過度表達的肝癌細胞中被直接研究,這是一個解釋HBV攝取機制的有趣工具。

圖爾大學研究人員介紹,2018年進行的一項研究調查了HBV進入HepG2 NTCP細胞的情況,並顯示水飛薊賓(一種已知的抑製網格蛋白介導的內吞作用的藥物)減少了HBV進入。與這一結果一致,最近的一項研究證明了AP-2和EPS15銜接蛋白參與了HepG2 NTCP細胞和PHH感染HBV。與這兩項研究結果一致,另一項研究表明,沉默HepG2 NTCP細胞中的caveolin-1並不能減少HBV感染,而CHC、dynamin-2(DNM2)和AP-2的沉默導致感染水準大大降低。
此外,在這項研究中,電子顯微鏡分析顯示HBV顆粒存在於早期感染的網格蛋白包被的囊泡中。其他幾條證據支持CME是HBV體內進入的主要途徑。事實上,CME已經被證明在肝細胞、鐵穩態、肝脂肪變性和病毒誘導的肝感染中,發揮了許多重要作用。除了作為HBV的受體,NTCP還具有吸收膽汁鹽的生理功能,並通過CME循環到質膜上。這就是目前科學界掌握的受體結合介導的內吞作用(2020年6月18日 Cells 法國圖爾大學Charline Herrscher、Philippe Roingeard、Emmanuelle Blanchard)。返回搜狐,查看更多
責任編輯: