導語:據世界衛生組織(WHO)國際癌症研究機構(IARC)最新報告稱,僅2018年全球一年就新增1810萬癌症病例,死亡人數鋼彈960萬,全世界罹患癌症的人數在「迅速增長」。而癌症新葯的出現,正在給「身處絕境」的患者帶來最後一絲希望。

人人「談癌色變」,癌症這一惡疾逐漸成為無數家庭的噩夢,剛過去2018年更是群英因癌消逝的一年。
7月6日,《我不是葯神》將癌症之一的白血病血淋淋的剖露在我們眼前,我們嘆息,渴望「神葯」的出現;
11月30日,朋友圈被《重大突破! 昨日,美國FDA正式上市「廣譜」抗癌藥,治癒率鋼彈75%!》這篇文章刷爆了屏,人們歡慶醫學史上的又一偉大創舉和傳奇!
儘管前者是電影美學的表現手法,卻幀幀刻入人心;後者被闢謠,不是治癒率75%,而是「有效率」,但名為「TRK抑製藥」的抗癌藥,對特定的腫瘤人群,確實有效。
2018年,是癌症新葯收穫頗豐的一年
美國癌症新葯的進展
4月14號,一年一度的美國癌症研究協會年會(AACR)在美國芝加哥召開,由世界排名第一的癌症中心MD安德森癌症中心(MD Anderson)首次揭示了一種對於RET突變患者安全有效的研究藥物——BLU-667。

BLU-667是下一代酪氨酸激酶抑製劑,對RET的選擇性比其他激酶測試的選擇性高100倍,並已被證明可有效阻止與多種激酶治療抵抗有關的基因突變!可用來治療既往難以治療的甲狀腺髓樣癌(MTC)、甲狀腺乳頭狀癌,非小細胞肺癌,結直腸癌和膽管癌等。
9月6日,美國食品和藥物管理局(FDA)授予Loxo Oncology在研藥物LOXO-292突破性療法的認定,該藥用於治療攜帶RET基因變異的非小細胞肺癌(NSCLC)和甲狀腺髓樣癌(MTC)患者,並取得了77%的總體緩解率!這也讓更多的腫瘤患者看到了希望!
另外,作用於乳腺癌的Lynparza(olaparib,奧拉帕尼)、作用於急性髓性白血病(AML)的Tibsovo(ivosidenib)、作用於非霍奇金淋巴瘤的Truxima(利妥昔單抗-abbs)等等,相繼被FDA批準,開始走向大眾。
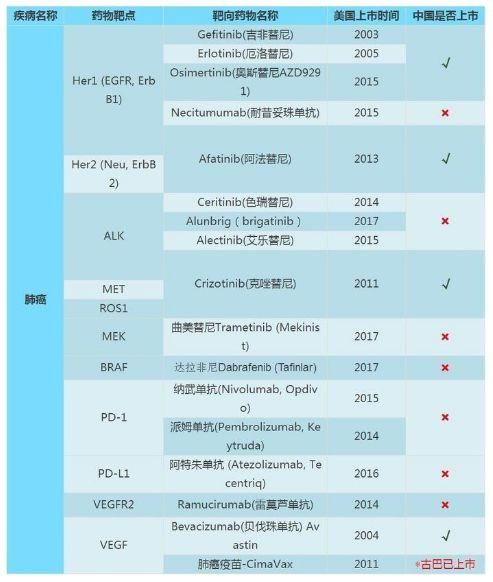
中國癌症新葯的「突破」與「尷尬」
2018年,我國上市了18個癌症新葯,其中絕大多數屬於靶向葯和免疫葯,這18個新葯的適應證涵蓋了10多種腫瘤。值得慶賀的是, 上市藥物中有4個是我國自主研發的——安羅替尼、吡咯替尼、呋喹替尼和特瑞普利單抗。

上海交通大學附屬胸科醫院韓韓寶惠教授表示:「99%以上的原研新葯,是國外葯企研發的。在臨床試驗整個數據裡95%以上的數據都是從國外,尤其是歐美的患者身上得到的。」
隨著對腫瘤研究的更加深入,新葯的層出不窮,正在給越來越多陷入絕望的患者帶來了生的希望,也讓腫瘤科醫生滿懷期待。但我國癌症新葯受試者參與臨床試驗的數據,卻並不太樂觀。
2018年,我國癌症新葯受試者或近5萬人
癌症新葯要想上市,投入患者懷抱,就必須經住新葯臨床試驗這一環的考驗。
近年來,隨著新葯審批制度改革,新葯上市速度明顯提升,新葯臨床試驗數量也隨之提升。新葯受試者,也被稱為試藥人。尤其在癌症新葯中,受試者並不是少數。

國家藥品審評中心(CDE)藥物臨床試驗登記與公示平台數據顯示,截至2019年1月2日,平台登記(獲得CTR號)的臨床試驗總數為10197項,其中2018年登記的新葯(還未在國內上市的藥品)臨床試驗數為約950項,癌症新葯臨床試驗數約250項,根據這些臨床試驗招募中公布的樣本數量,去年一年需要癌症新葯受試者近5萬人。
新葯臨床試驗的增多,與目前國內葯企的研發意識和競爭意識增強不無關係。一個新葯剛出來如果還沒有同類藥品,那將會非常有競爭力;而如果葯企晚兩年研發出來,恐怕「滿地都是同樣藥效的競爭品」,那就只能打價格戰了。
58%的癌症患者自願承擔新葯試驗帶來的風險
2018年底,有一項針對1000名癌症患者的參與新葯臨床試驗情況調查,有效問卷820份,其中參與過藥物臨床試驗的癌症患者80人,佔患者總數的9.76%,佔患者總數的9.76%,有意願參加新葯臨床試驗的癌症患者有65.85%,約80%的患者擔心新葯帶來的副反應風險,但仍有58%的患者願意承擔新葯試驗帶來的風險。

對此,北京大學腫瘤醫院胸部腫瘤內科主任醫師方健表示:「晚期腫瘤病人,能夠參與(新葯)臨床試驗是一個特別好的治療手段,因為現有的治療水準已經到這了,想突破就只能等新葯上市,新葯上市一般都得好幾年以後了,很多病人等不到上市。」
風險與效益並存。癌症新葯試驗,有可能癌症病人的最後一根「救命稻草」,也有可能是活人充當小白鼠的容器。拋開人體對象醫學研究的道德原則不說,癌症患者更擔心的,是新葯臨床試驗中新葯的副反應、被隨機安排到對照組或安慰劑組等風險。
是「新」葯還是「神」葯?
神葯,我們可以理解為是一種「可望不可即」的狀態;而「新葯」,患者乃至亞健康人群,更關注的是「安全性」、「閱聽人面」、以及「經濟支付力」等問題。
臨床上有句話叫「異病同治」,儘管癌症(腫瘤)的發生發展錯綜複雜,不同的腫瘤更是天差地別,但在無數的致病原因中還是會有交集,也就是大家所說的基因靶點。因此,理論上針對這一基因靶點的葯對於存在這一基因靶點的腫瘤都應有效。

近年來層出不窮的癌症新葯,大多也是以靶向葯為主,只是同一基因靶點對不同腫瘤的發生發展所起的作用不同,藥物的有效率便會不同。
安全性
靶向治療是針對特定致癌基因突變的治療,它就像「雷射製導炮彈」,命中率高,威力強,打擊目標外的損傷非常小。上述的免疫葯大多都屬於PD-1/PD-L1抑製劑,它本身並不攻擊腫瘤,而是通過恢復機體對腫瘤的免疫反應來發揮作用。相較於傳統化療,「新葯」不會對正常組織和細胞造成傷害。

作為患者,不應畏懼不良反應,而應該積極預防治療。在使用上述靶向葯前,應顧問專業醫生,進行相關檢測後再考慮用藥;服藥期間一旦出現不適,也應積極和醫生溝通。
閱聽人面
臨床上還有句話,叫做「靶向治療,檢測先行」或「先檢測後治療」,指的就是首先要進行基因檢測。這是因為靶向葯通常隻對具有特定基因突變的患者有效。大家必須明確的是,即使是所謂的「廣譜」抗癌藥,也不是對所涉及的所有腫瘤患者都有效,前提是患者得存在某個基因靶點,因此同一款葯可能只有對一小部分人有效。

免疫治療是近年來炙手可熱的「新星」,2018年上市的新葯中也不乏它的身影。目前,免疫治療主要通過檢測PD-L1表達來篩選患者,如果不經篩選,免疫治療在總人群中的有效率為20%~30%。
經濟支付力
說白了,就是一個問題——「新葯」進醫保了嗎?這也是決定「新葯」能否從「神葯」真切投入人民懷抱的關鍵。

以治療乳腺癌的曲妥珠單抗(赫賽汀)為例,2017年版醫保目錄公布前,一支440毫克的曲妥珠單抗(赫賽汀)平均售價為24500元,乳腺癌患者一個治療周期至少需要注射14支,費用全部自付。
國家醫保目錄頒布後,全國共有20個省區市對外公布了新版醫保目錄調整方案或執行國家版醫保方案。其中,曲妥珠單抗確定的支付標準為7600元,一個治療周期的費用由34.3萬餘元降至10.6萬餘元,這10.6萬餘元還將按照一定的醫保支付比例進行報銷,如烏魯木齊市職工醫保乙類藥品最高報銷比例為90%,那麼原來花34萬餘 元,現在患者只需花1萬餘元。
醫保目錄的動態調整,下一步將成為現實。對醫藥企業而言,新版醫保目錄的調整無疑是一項重大政策動向,一些葯企旗下的產品得以進入醫保目錄,在一定程度上 為葯企帶來利好。

不過,近年來醫保目錄的擴容量巨大,但醫保基金有限,目錄不可能無限擴容,大量需要增補的藥品與有限的調整名額之間的矛盾,是目前各地開展目錄調整工作的最大難處。
雖然新葯為患者提供了更多選擇,療效也很有優勢,但目前為止大多都沒有被納入醫保範圍。因此,「新葯」的治療費用都較高。
我們呼籲企業頒布良好的贈葯政策,也希望藥物能夠儘早進入國家醫保目錄。同時,也希望患者不要盲目追捧,好藥用在「刀刃」上,適合自己的才是最好的。如果的確適合使用新葯,也可以通過參與臨床試驗來獲得治療。