記者丨光亞
來源丨醫學界腫瘤頻道
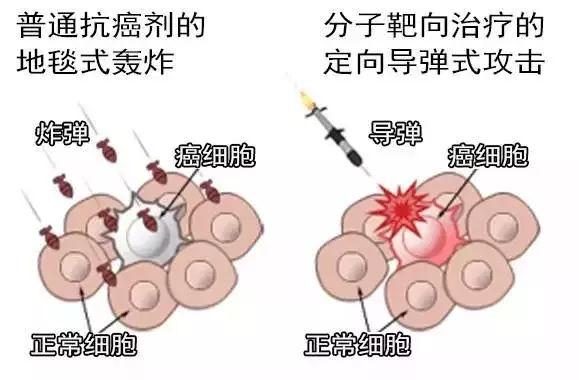
近年來針對HER2+患者的研究非常豐富,HER2+患者靶向葯使用時長、聯合應用等的研究一直有更新,這部分患者的無病生存期(DFS)或階段性DFS已從75%上升到94.1%,數據可觀。隨著探討深入,精準治療開始關注HER2+且HR+的患者,如何用新輔助治療讓這部分患者得到更積極治療呢?
早前就有研究認為,HER2+、HR+與HER2+、HR-是兩組生物學行為不同、對治療反應不同的人群,兩者的治療策略可能不同。對HER2+、HR+乳腺癌,是否可以選擇靶向聯合內分泌治療而不加化療呢?
HR+/HER2+乳腺癌精準篩選後可避免化療
8月17日,第三屆亞洲乳腺癌會議」暨「第十一屆天津國際乳腺癌會議」中,復旦大學腫瘤醫院吳炅教授在報告中給出提示。他解讀了2018年ASCO年會報告的PerELISA的研究,認為根據HR+、HER2+患者對新輔助內分泌的敏感性以及PAM50等篩選方法,可以一定程度上避免化療。一起來看看。
這項研究入組患者特徵為絕經後可手術的HER2+、HR+患者,患者先接受2周來曲唑治療,然後檢測Ki67,Ki67變化較治療前基線降低≥20%界定為內分泌治療反應型。

內分泌治療反應型共納入44例,給予雙靶向治療(曲妥珠單抗+帕妥珠單抗)+來曲唑新輔助治療;內分泌治療無反應型共納入17例,給予單周紫杉聯合雙靶向治療(曲妥珠單抗+帕妥珠單抗)。
結果顯示:

內分泌反應組pCR率為20.5%,乳房客觀緩解率達到74%、保乳率為65.9%、乳房切除到保乳增加了54.5%。

在內分泌無反應組,數據也很可觀,pCR率為81.3%,乳房客觀緩解率達到94%,保乳率為62.5%、乳房切除到保乳增加了57%。

特別的是,研究者對內分泌反應組患者又進行了PAM50基因分型,HER2E亞組患者的pCR率可以達到45%。
「數據非常有啟發,說明在HER2+患者中,仍可以找到某些方法,找到可能降低不良事件的治療策略,讓患者獲得同樣好的療效。」吳炅教授稱。
應對內分泌治療耐葯,需要圍追堵截
依照乳腺癌基本分型方法,雌激素(ER)陽性乳腺癌佔整個患者群很大一部分,據統計有60%-70%。這類患者整體預後佳,內分泌治療是有力改善預後的方法。
但不管哪種方法,仍有約30%的腔面型乳腺癌在內分泌治療後出現複發轉移,臨床仍有兩大困惑,一是患者近期內分泌耐葯,二是遠期複發轉移問題。
現有內分泌治療手段有以下幾種:
(1)選擇性雌激素受體調節劑(SERM),包括他莫昔芬、托瑞米芬、雷洛昔芬等;
(2)選擇性雌激素受體下調劑(SERD),如氟維司群;
(3)芳香化酶抑製劑(AI),如阿那曲唑、來曲唑、依西美坦等;
(4)卵巢功能抑製,包括用促黃體生成素釋放激素(LHRH)類似物或卵巢手術/放療等;
(5)其他。
研究顯示,約1/3 ER+患者在他莫昔芬治療2-5年內出現耐葯;ER+患者,約50%複發與66%死亡事件發生在5-15年。因此研究者關注的重點更多在內分泌治療耐葯上,現在的觀點認為,要區別對待內分泌治療耐葯和敏感複發兩種情況,並根據複發時間決定治療策略。
僅對耐葯就要區分原發耐葯和繼發性耐葯。前者是輔助內分泌治療2年內複發或一線內分泌治療6個月內複發轉移;後者是輔助內分泌治療2年後至結束後1年內複發轉移或一線內分泌治療6個月後複發轉移。而敏感性複發指輔助內分泌治療結束後1年以上複發轉移。
第三屆亞洲乳腺癌會議」暨「第十一屆天津國際乳腺癌會議」中,復旦大學腫瘤醫院余科達教授這樣形容應對內分泌耐葯的策略——多層面逆轉。
因為細胞內外各通路與ER通路存在互動作用,逆轉內分泌耐葯要從多層面入手:
「針對核心」的ESR1突變;
「打擊旁路」,即用PI3K/AKT/mTOR通路抑製劑;
「阻斷上遊」,使用EGFR/HER2/FGFR等受體抑製劑;
「抑製下遊」,用細胞周期通路及CDK4/6抑製劑。
(1)針對核心
有研究顯示,某些已被發現的ESR1突變,其編碼的ERα可以在沒有激素存在的情況下激活,提示對採用直接靶向ER的藥物,如高劑量氟維司群是有效的,而對阻斷雌激素的AI治療可能無效。
(2)打擊旁路
PI3K/AKT/mTOR通路與ER通路存在相互作用,聯合通路抑製劑及內分泌藥物可產生協同作用,能逆轉耐葯。
| 靶點 | 抑製劑或抗體 |
| PI3K | BKM-120 |
| GDC-0941 | |
| GSK2126458 | |
| AKT | MK-2206 |
| perifosine | |
| mTOR | Everolimus(依維莫司) |
| Temsirolimus |
2013年BOLERO-2研究和2018年PrE0102研究說明,mTOR抑製劑依維莫司聯合內分泌藥物可使耐葯患者獲益。
復旦大學腫瘤醫院基於149例癌組織測序結果,繪製了中國乳腺癌的PI3K/AKT通路突變譜,結合文庫進行「功能性突變篩選」,相應靶向藥物正在研發中。
(3)阻斷上遊,即EGFR/HER2/FGFR信號通路。酪氨酸激酶受體旁通路激活,引起內分泌治療耐葯。

最新NSABP B-52試驗是將HER2陽性、ER和/或PgR陽性浸潤性乳腺癌通過粗針活檢確認,隨機分組為TC+曲妥珠單抗+帕妥珠單抗組,以及TC+曲妥珠單抗+帕妥珠單抗+雌激素剝奪組。主要終點為乳腺和淋巴結pCR率。結果提示,雖然兩組pCR相差較小,但說明針對某些人群仍有差異。
(4)抑製下遊,針對CDK4/6細胞周期通路。
CDK4/6抑製劑與內分泌藥物產生協同效應,逆轉內分泌耐葯。PALOMA3研究,一項全球性、隨機雙盲安慰劑對照臨床研究顯示,CDK4/6抑製劑Palbociclib聯合氟維司群顯著延長HR+/HER2-內分泌耐葯晚期乳腺癌患者的PFS,目前該葯已在國內外上市。針對CDK4/6的MONARCH2和MONALEESA3研究也同樣提示了CDK4/6對耐葯問題的有利作用。
精準醫學時代,需根據不同耐葯機制選擇靶向藥物,逆轉內分泌耐葯,進一步改善患者預後。余教授認為,未來的內分泌治療,還需要高效挖掘分子靶點,多組學多視角整合多靶點,防治多通路逃逸和交叉耐葯。
註:本文部分圖片截取自此次大會專家報告。
8月17日,由中國抗癌協會乳腺癌專業委員會主辦、天津市腫瘤醫院承辦的「第三屆亞洲乳腺癌會議」暨「第十一屆天津國際乳腺癌會議」在津正式召開。
本次會議作為國內首個美國臨床腫瘤學會(ASCO)乳腺癌海外會場,由中國抗癌協會乳腺癌專業委員會、美國臨床腫瘤學會主辦,天津市腫瘤醫院承辦,邀請美國、英國、日本、韓國、印度等國際知名腫瘤專家,匯聚800餘名包括香港、台灣在內的來自全國30餘個省、市、自治區的乳腺腫瘤學者,共同梳理乳腺癌診療的前沿熱點和科研成果,對ASCO大會的核心資訊和焦點問題進行精選匯總和專題解讀,並針對乳腺癌精準醫學策略、乳腺癌轉化醫學、乳腺癌影像診斷與外科治療、靶向治療、多學科協作及個體化治療等方面進行學術交流和探討,旨在傳遞乳腺癌領域的最新成果和發展動態,進一步推動乳腺癌的整體發展。


(本文為醫學界腫瘤頻道原創文章,轉載需經授權並標明作者和來源。)