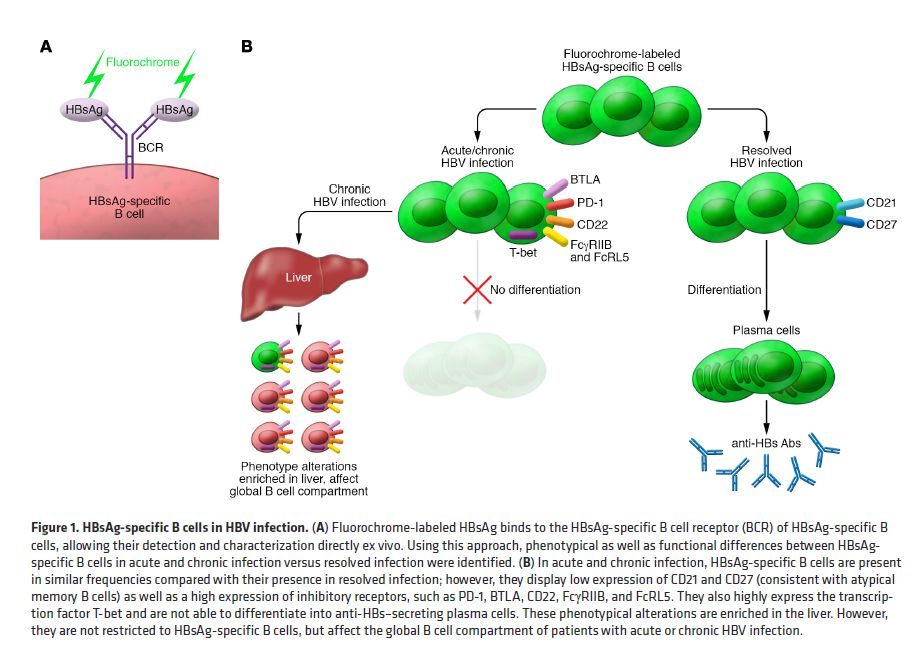
南澳疫苗研究公司Vaxine Pty Ltd研究人員發現,在確定了旗下一種新的佐劑B肝病毒(HBV)疫苗安全性和有效性時,觀察到其是一種潛在的治療性疫苗,可用於預防慢性肝炎病毒感染。目前,這項研究課題是,疫苗治療控制或治療慢性B肝病毒感染(HBV003)的隨機對照第1期研究。

B肝在研新藥Hepadvax,治療性疫苗,已證明動物抑製潛力
該公司研究人員介紹,這項正在進行預防性B肝病毒疫苗的人體臨床試驗證實,與標準明礬佐劑的B肝疫苗相比,這種疫苗在誘導低反應人群的B肝表面抗體(HBsAb)的發展中更有效地誘導血清轉化,這種新疫苗有望在慢性感染者中,誘導HBV病毒控制或血清轉化。南澳疫苗研究人員指出,慢性B肝是世界上常見的肝髒感染,可以導致肝硬化和肝癌,當前,可用的B肝疫苗主要是在預防B肝病毒感染方面,有效性可達到90%-95%。
這種疫苗是一種來自B肝病毒的蛋白質和氫氧化鋁佐劑的組合(潛在治療性疫苗Hepadvax)。有必要添加氫氧化鋁佐劑,因為蛋白質本身無法刺激足夠強大的免疫反應來為人體提供足夠保護。Vaxine公司開發正在開發一種更有效的B肝疫苗,已在動物實驗中證明對已感染個體的抑製HBV病毒潛力。同時,我們還發現,這種疫苗在健康志願者身上是安全有效的,下一步我們會在慢性B肝病毒感染者身上進行試驗。

這項試驗預計納入40名受試者,採用隨機、平行作業,掩蔽:三重(參與者、研究者、結果評估者)。掩蔽說明:受試者、研究者、結果評估者將對受試者接種的疫苗均盲。這項研究預計開始日期:2021年1月,預計初步完成日期:2023年12月。實驗組:研究藥物是定期肌肉注射治療性B肝疫苗(含氫氧化鋁佐劑的乙型肝炎表面抗原,含Advax-2佐劑的preS-HBsAg),分2個周期進行,第1個周期為第0天、第14天、第28天、第42天;在第70天、第84天、第98天、第112天進行4次免疫的第2周期。
這項研究使用的研究藥物核心是,Advax-2佐劑聯合重組B肝表面抗原顆粒的B肝疫苗。研究人員將觀察如下主要結果指標:接種後12個月,與活性對照疫苗相關的疫苗相關不良事件(主要評估安全性);最終免疫後1個月和12個月,B肝病毒載量。本研究觀察的次要結果指標:最終免疫後1個月和12個月,血清轉化為e抗原(如果基線e抗體陰性)和血清轉化為表面抗原;

最終免疫後1個月和12個月,T細胞反應;最終免疫後1個月和12個月,記憶性T細胞對B肝病毒應答的研究進展B細胞反應。本研究為第1期臨床研究,不接受健康志願者,主要對象為18歲以上成人;男性或女性;B肝表面抗原/B肝DNA檢測表明HBV慢性感染(有或無肝硬化)的最新證據(目前接受核苷類藥物的受試者可能沒有檢測到B肝病毒DNA);能夠提供書面知情同意書等。
排除在本研究外的標準:B肝核心抗原IgM抗體陽性,其余HBV標誌物陰性,表明急性感染;肝轉氨酶高於正常上限的5倍;Childs-Pugh評分對肝硬化死亡率為B級或更高;HDV、HCV或HIV呈陽性;研究人員認為可能存在藥物濫用或酒精濫用等。Vaxine公司研究人員認為,目前可使用預防B肝病毒感染的預防性疫苗有效性可達90%以上,在添加氫氧化鋁佐劑後,我們發現能夠刺激足夠強大的免疫反應來提供充足保護。

小番健康結語:以上研究編號為NCT03038802,已可在南澳疫苗研究公司Vaxine Pty Ltd查詢到,預計將於2021年1月啟動這項第1期研究。本研究主要介紹Vaxine公司已經開發一種更有效的B肝疫苗(Hepadvax),在動物模型中顯示,對已感染的個體抑製HBV潛力,並已在健康志願者中進一步證明其是安全有效的,後續會在慢性B肝病毒感染者中完成,預計本研究將於2023年12月結束(NCT03038802 Vaxine Pty Ltd)。返回搜狐,查看更多
責任編輯: