陳捷亮, 袁正宏
復旦大學上海醫學院
HBV持續感染引起的慢性乙型肝炎(CHB)嚴重危害人類健康。雖然隨著乙型肝炎疫苗接種和傳染病防控的推進,乙型肝炎新發病例數已大幅降低,但據統計全球仍有約2.4億HBV慢性感染者(其中我國逾0.9億),每年近百萬人死於HBV慢性感染相關肝衰竭、肝硬化和原發性肝癌等肝臟疾病。目前,臨床上用於CHB治療的藥物主要有兩大類,包括干擾素(IFN)和核苷(酸)類似物(NAs),但均不能有效清除病毒和治癒乙型肝炎。大量CHB患者需長期乃至終身抗病毒治療,極大降低了患者的生活質量並造成沉重負擔。
HBV感染慢性化是病毒和宿主相互作用的結果,HBV獨特的複製方式對其在肝細胞內建立和維持持續性感染起到了關鍵作用。HBV是一種歷經漫長進化、具逆轉錄複製特性的嗜肝DNA病毒,基因組為鬆弛環狀部分雙鏈DNA(relaxed circular DNA, rcDNA),大小僅約3.2 kb;HBV感染進入宿主肝細胞後,rcDNA會經由核心顆粒脫衣殼而釋放入核,進而形成病毒在整個複製周期中關鍵的複製中間體——超螺旋的共價閉合環狀DNA(cccDNA),其在瓊脂糖凝膠電泳中的條帶位置有別於rcDNA,位於2.0 kb標記附近;cccDNA在細胞核內與宿主組蛋白和非組蛋白等結合組裝成微小染色體,經由病毒DNA複製得以補充積聚,形成cccDNA池(cccDNA pool),同時,複製產生的新病毒可在肝內進一步播散。cccDNA承擔了HBV基因組儲存庫和病毒轉錄複製模板的雙重角色,且相對穩定很難被根除,因此被認為是乙型肝炎慢性化和難以治癒的「元兇」。本文從現有藥物對cccDNA的影響切入,分析cccDNA含量和活性的主要受控因素,探討cccDNA池難以清除的關鍵特性環節,提出未來靶向cccDNA和研究的重點,以期加深對乙型肝炎慢性化和難以治癒機制的理解,為研發新型沉默清除cccDNA的策略、最終實現乙型肝炎治癒提供參考與新視角。
1 當前CHB治療藥物對cccDNA的影響
1.1 NAs治療對cccDNA的影響
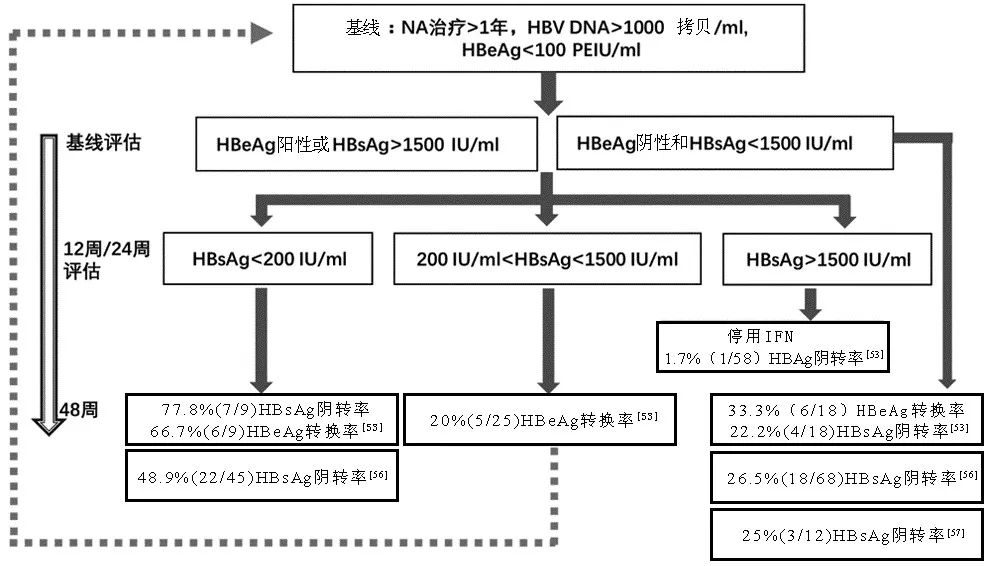
NAs是一類靶向抑製HBV逆轉錄酶的藥物,可顯著抑製HBV逆轉錄複製、降低病毒載量,但存在長期服藥和產生耐葯等缺陷。NAs從作用機制上不直接靶向核內既有cccDNA池,但理論上NAs長期治療過程中可通過持續抑製rcDNA的形成而影響cccDNA的回補進而逐漸耗竭既有cccDNA池;此外,NAs治療所致病毒載量下降可部分促進抗病毒免疫應答的恢復從而控制清除cccDNA。臨床觀察表明,NAs短期治療對cccDNA含量的影響有限,長期治療則可使肝內cccDNA總體水準逐漸降低,但尚不能使之完全清除,原因之一可能是NAs抑製HBV逆轉錄酶的效率雖然很高但仍未達100%,而即使很低水準的病毒複製亦可使cccDNA池因得到回補而不被耗竭。本課題組前期利用乙型肝炎患者肝穿刺組織進行原位cccDNA檢測亦發現,阿德福韋長期治療雖然可使血清HBV DNA被抑製到檢測水準之下以及使肝內HBV抗原水準和細胞漿HBV DNA含量大幅降低,但肝細胞核內仍可檢測到一定水準的cccDNA。上述研究均提示cccDNA很難通過NAs治療而被徹底清除,並且只要機體未建立有效的抗HBV免疫應答,肝細胞核內殘存的cccDNA在停葯後很容易實現回補及恢復病毒複製。正因為如此,對大部分患者來說,長期使用NAs阻斷cccDNA回補以保持cccDNA池處於低水準是十分有必要的,停葯通常會出現不同程度的HBV DNA複製及其載量反跳和臨床病情複發加重。近年有學者提出可對部分NAs長期治療的「優勢」患者(HBsAg水準低或陰性)實施停葯觀察,主要是寄望於患者在NAs治療過程中或停葯後短期內自身建立持續有效控制病毒複製和抗原表達的免疫機制,但臨床實踐表明複發率仍較高,相關風險該如何評估和管控尚有待系統研究。
1.2 IFN治療對cccDNA的影響
IFN是一類在機體免疫防禦中發揮關鍵作用的細胞因子,於1957年首次被發現,因具有干擾病毒感染複製的效應而得名,後來進一步被發現具有免疫調節和抗腫瘤等功能。根據所結合IFN受體的不同,其一般被分為Ⅰ(IFNα/β等)、Ⅱ(IFNγ)和Ⅲ(IFNλ)型,其中被廣泛用於治療CHB的為IFNα家族中的2a/2b亞型和相應聚乙二醇化IFNα(PEG-IFNα)。相較NAs,IFN治療CHB具有療程有限、HBV抗原清除率和持續應答率相對較高等優勢,已使大量患者獲益,還被報導能更有效地降低CHB患者肝細胞癌發生的風險。此外,近期日本一項研究報導核苷酸類藥物(阿德福韋、替諾福韋)可通過誘生IFNλ而發揮核苷類藥物(拉米夫定、恩替卡韋)所不具有的額外抗病毒效應,隨後韓國一項研究認為這可能有利於進一步降低肝細胞癌發生的風險。雖然這兩項發現還有待驗證,但從另一個角度凸顯了IFN在控制HBV慢性感染及所致肝臟疾病中的獨特角色。
由於IFN理論上作用於任何表達Ⅰ型IFN受體的細胞(幾乎各類細胞均表達),其生物學效應較複雜,已有研究表明IFN通過病毒學和免疫學兩方面機制共同控制和清除HBV感染——在抗病毒方面,IFNα通過結合Ⅰ型IFN受體激活JAK-STAT信號通路,誘生具有各種抗病毒功能的干擾素刺激基因(interferon-stimulated genes, ISGs),至今已陸續鑒定了十幾種具有較強抗HBV功能的ISGs,包括MxA、TRIM22、MyD88、ZAP、ISG20、IFITMs和APOBEC家族蛋白等,其抗HBV的環節主要集中在抑製HBV轉錄後RNA穩定性、病毒蛋白翻譯和裝配出胞等環節。本課題組通過系統研究發現了一種IFNα抗病毒的新機制,即在HBV拮抗肝細胞內IFN誘生和應答的情況下,IFNα通過作用於肝竇內皮細胞和巨噬細胞等,將誘生的抗病毒分子經由外泌體從肝非實質細胞傳遞到HBV感染的肝細胞,以此抑製HBV在肝細胞中的複製。在免疫調節方面,IFN具有活化巨噬細胞、自然殺傷(NK)細胞和T淋巴細胞等功能,可通過調節免疫微環境中細胞因子和浸潤細胞的數量及譜式等對感染有HBV的肝細胞施以免疫壓力以控制清除病毒,但具體效應機制及免疫網路調控機制仍有待深入闡明。
關於IFNα對cccDNA的作用,大規模系統性臨床研究不多,國內有研究表明IFNα治療在部分患者中可致cccDNA一定程度降低,其中出現HBeAg血清轉換的患者肝內cccDNA下降幅度總體大於未發生HBeAg血清轉換者;相比NAs單葯治療,IFNα與NAs聯用可更為有效地降低cccDNA,治療48周後肝內cccDNA水準較低者停葯複發率更低。在體內外模型研究中,Protzer團隊報導高濃度IFNα作用於肝細胞可誘導脫氨酶APOBEC3A的表達,促使cccDNA發生C→U突變形成去嘌呤或去嘧啶位點(AP位點)進而被細胞鹼基切除修復機制識別而降解清除,但此結果尚未被廣泛驗證。更多證據顯示IFNα對cccDNA的作用主要表現為抑製cccDNA轉錄活性,而非直接降解cccDNA:Levrero團隊在基於HepG2細胞的HBV轉染模型中發現IFN處理通過降低cccDNA微小染色體組蛋白乙醯化修飾來抑製cccDNA的轉錄活性;本課題組和Bartenschlager團隊先後在多種體外HBV感染模型中發現IFN在強烈抑製HBV轉錄和抗原表達的工作濃度下,對cccDNA含量無明顯下調作用;一項利用人肝嵌合鼠的研究顯示,在缺失免疫系統的情況下,IFN可有效降低HBV RNA、HBeAg和HBsAg的水準,但對cccDNA含量無顯著影響,進一步支持IFN對cccDNA無直接降解作用,但不排除高濃度IFNα處理對肝細胞有毒性或IFNα在體內通過調節免疫反應等機制而間接降解cccDNA的可能性。
2 cccDNA含量和活性的主要受控因素
2.1 免疫因素
HBV母嬰垂直傳播和嬰幼兒感染HBV慢性化比率分別為90%以上和20%~50%,而成年人感染HBV慢性化比率僅約5%,提示成熟健全的免疫應答系統在控制和清除HBV感染中扮演了重要角色。此外,即使HBV複製和抗原指標長期陰性,在免疫抑製治療和化放療等情況下,一定比例的患者會出現HBV再激活,進一步提示免疫因素在控制病毒複製和cccDNA活性中的關鍵作用。近年研究表明,HBV感染可在一定程度被宿主天然免疫系統所感知,誘生的炎性細胞因子IL-6、IL-1β和IFN與活化的NK細胞和NKT淋巴細胞等發揮控制清除HBV複製感染的作用,可抑製cccDNA的轉錄活性或經由 「非殺細胞」和「殺細胞」兩種途徑降解清除cccDNA。在天然免疫所致病毒載量大幅下降後,HBV特異性CD8+細胞毒性T淋巴細胞(CTL)所介導的免疫反應逐漸佔據主導,CTL通過識別被感染肝細胞表面人類淋巴細胞抗原-Ⅰ遞呈的HBV抗原肽進而導致肝細胞凋亡或壞死,cccDNA隨之被清除,同時T淋巴細胞分泌的IFNγ和TNFα等細胞因子被報導可促進cccDNA「非殺細胞」式降解。大量研究表明,慢性HBV感染中天然免疫和T淋巴細胞功能受損,這可能與cccDNA池的維持有關,而抗病毒治療有助於HBV特異性T淋巴細胞功能的恢復。體液免疫在清除胞外病毒防止再感染和協助清除病毒感染細胞方面有著重要作用,特異性抗HBs抗體的出現被認為是CHB治癒的核心標誌之一,而乙型肝炎免疫球蛋白(HBIG)被用來預防乃至治療HBV感染,還有報導顯示抗HBs抗體可被內吞入肝細胞而抑製HBV病毒顆粒和亞病毒顆粒分泌,但體液免疫能否直接影響cccDNA含量和活性尚不清楚。
2.2 宿主肝縱橫諜海更新
與EB病毒和卡波氏肉瘤相關皰疹病毒等DNA病毒的基因組DNA可錨定於宿主染色體上不同,一般認為HBV cccDNA以遊離於人類基因組染色體之外的形式存在於細胞核。因此當宿主細胞有絲分裂時,cccDNA理論上會丟失或隨機分布到子代細胞。人肝嵌合小鼠模型表明肝縱橫諜海可致cccDNA含量急劇下降,而隨著縱橫諜海速度減慢病毒學指標又會呈現反跳,支持cccDNA在肝縱橫諜海時會丟失;Mason等通過檢測肝細胞內HBV整合的DNA提出肝細胞克隆增殖理論,而整合有HBV DNA的肝細胞內cccDNA呈陰性則提示了cccDNA可隨肝縱橫諜海而丟失或由其他非殺細胞機制清除。需注意的是,正常情況下肝縱橫諜海更新的周期較長,因此理論上縱橫諜海所致cccDNA含量下降是個較為緩慢的過程;而從縱橫諜海更新有利於cccDNA清除這個角度來說,雖然NAs可通過抑製cccDNA回補而使其含量隨縱橫諜海而逐漸稀釋變少,但由於NAs治療可伴有肝臟炎症的減弱和肝細胞更新的減少,這可能又減緩了cccDNA池的耗竭。
2.3 肝代謝功能狀態和個體遺傳背景
HBV有著強烈的嗜肝性和種屬特異性,其中一大原因是cccDNA轉錄及HBV完成複製周期所需的宿主因子部分為人肝細胞所特異性高表達,如HNF1/4α、FXR、CREB、C/EBP及近年李文輝團隊鑒定到的HBV入胞相關受體NTCP等。由於這些因子與肝臟的糖、脂肪、膽固醇和膽汁酸代謝密切相關,因此肝細胞自身的代謝和營養功能狀態對cccDNA的活性和HBV複製有著顯著的影響。同時,HBV感染複製可反過來影響肝細胞功能進而與HBV致病相關。本課題組近期鑒定發現維甲酸受體激動劑類小分子化合物可有效控制HBV cccDNA轉錄,部分機制可能與逆轉HBV感染所致代謝基因的異常表達有關,加深了對cccDNA活性調控的理解,並為新型靶向策略的研發提供了新思路。鑒於肝細胞代謝功能狀態對cccDNA的作用,其可能也影響著臨床治療效果和各類病毒學指標變化,仍有待研究闡明。此外,有研究提示個體遺傳背景對HBV的易感性、治療效果和cccDNA的活性及穩定性也有一定影響。
3 cccDNA難以清除的關鍵特性環節
3.1 cccDNA穩定性和半衰期
目前為止對cccDNA是否穩定以及其半衰期多長仍存有很大爭議,不同體內外模型所測定的cccDNA半衰期不盡相同,從幾十小時到幾個月不等。主流的觀點來自於一項土撥鼠模型的研究,其提示cccDNA在非分裂狀態的肝細胞中可長期保持穩定;另一項利用小鼠模型的研究進一步表明HBV複製可能會導致其所在肝縱橫諜海周期受阻滯,而不分裂的肝細胞很可能扮演了病毒基因儲存庫的角色。由於cccDNA池中每個cccDNA分子所處的肝細胞的細胞周期和分裂狀態不同以及cccDNA自身在活性狀態和DNA序列等方面的差異,可推測它們的穩定性和代謝清除速率可能不盡相同。因此,整體cccDNA池的半衰期並不能精確反映單個cccDNA分子的壽命長短,而池中某些cccDNA分子可能與HBV慢性感染及停葯反跳等具有更為密切的關係。
3.2 cccDNA池含量和活性的動態調節
HBV cccDNA最初形成自rcDNA,經由病毒複製過程中新產生的rcDNA加以補充,使核內cccDNA的數量逐漸積累,但並不會無限制增加。一項體外研究認為HBV大HBs蛋白的含量對此起到了調節作用,HBV大HBs蛋白表達缺失會使得核內cccDNA數量增加6倍以上,提示HBV進化出了動態調控cccDNA池的反饋機制;另一項近期研究顯示,cccDNA傾向於定位在表達活躍的人類染色體區域附近。這些特性可能使得HBV能在cccDNA含量和活性間取得較好的動態平衡,以滿足病毒持續感染卻又不因自身轉錄複製而對宿主細胞產生明顯負擔和毒性。一般認為cccDNA池的大小可隨HBV感染自然史各階段的發展而呈動態變化,且單個肝細胞間所含cccDNA拷貝數變異度很大(從1個拷貝/細胞到幾十甚至上百個拷貝/細胞),但受限於樣本獲取和檢測手段,尚缺乏系統性和單細胞水準的研究。
3.3 cccDNA池的基因異質性
由於HBV的聚合酶缺乏校讀活性,HBV複製過程中突變概率相對較高。在HBV建立和維持持續感染的過程中,會產生各類病毒基因突變,包括低表達HBeAg的核心啟動子區突變株、不表達HBeAg的前C區突變株、低表達HBsAg的前S區缺失突變株和不被中和抗體識別的S區免疫逃逸株等,這些突變使具有免疫原性的各類病毒抗原表達降低,達到HBV逃避免疫監視和清除、逐步適應宿主免疫壓力進而與宿主長期共存的狀態。這會造成各處肝細胞中cccDNA存在基因異質性,因此可能使cccDNA池整體具有更強的適應性而不易被個別外力所清除或耗竭。
3.4 肝細胞外cccDNA池
除肝細胞外,HBV也可能於其他細胞如外周血單個核細胞建立其基因儲存庫,但此類HBV DNA是否能介導病毒感染和複製尚存有爭議,有待進一步研究闡明。
4 功能性治癒慢性乙型肝炎目標下cccDNA研究的重點
4.1 cccDNA生物學和模型技術的研究
由於當前治療手段已能夠較好地長期抑製HBV複製,如何減少病毒抗原表達從而進一步降低肝臟疾病風險乃至實現乙型肝炎治癒成為了臨床、基礎和產業界研究的共同重點。病毒學意義上,乙型肝炎治癒需徹底清除cccDNA,但cccDNA諸多特性決定了其難以被「斬盡殺絕」。近年來乙型肝炎「功能性治癒/臨床治癒」的概念被提出:即肝內cccDNA長期處於非活動轉錄狀態,血中HBV DNA陰性和HBsAg消失,此種情況下,雖然cccDNA仍少量存在,但功能學上已十分接近乙型肝炎治癒。魯鳳民團隊等還提出以停葯後HBV DNA和RNA持續低於檢測下限以及血清HBsAg低值陽性為特徵的「準臨床治癒」概念。由於cccDNA活性和含量很大程度上決定了HBV DNA、RNA和HBsAg的高低有無,上述被認為較為現實可及的目標的核心都是cccDNA含量低且持續性沉默,然而,對cccDNA穩定性和活性調控以及對宿主清除沉默cccDNA機制等認識的不足阻礙了靶向性藥物的研發和精準診療方案的製訂。因此十分有必要系統加強相關基礎研究,並結合臨床隊列加以驗證。需指出的是,當前cccDNA研究的一大瓶頸是其研究手段和技術仍相對局限且較為繁複,亟待體內外cccDNA研究模型的進一步優化及cccDNA檢測手段的標化和創新。
4.2 cccDNA活性標誌物與優化
IFN應答相關研究當前應用NAs抗HBV治療面臨的一大重要問題是能否停葯及何時停葯,cccDNA的含量及活性與此密切相關。然而,cccDNA的直接檢測受限於有創性的肝穿刺且檢測難度較大,因此能間接反映cccDNA含量和活性的生物標誌物如傳統的HBsAg以及新興的HBV RNA和HBV核心相關抗原(HBcrAg)等越來越多受到關注,但仍需在較大規模範圍內對它們的臨床意義作進一步研究比較,檢測技術也需進一步優化和標準化。此外,關於如何區分HBsAg是來自cccDNA或整合的HBV DNA及其如何影響HBsAg的指標意義也值得深入研究。
IFN的抗病毒機制決定了其在當前乙型肝炎治療中具有獨特地位,不少患者通過IFN治療達到了臨床治癒,然而總體應答率仍不到30%(治療48周HBeAg陰轉定義為應答),且由於IFN給藥方式不便和存在較多的不良反應,限制了其在臨床的廣泛應用。臨床觀察提示病毒基因型、病毒載量、基因變異以及患者ALT水準、年齡、性別和種族等病毒和宿主因素與IFN的療效相關。但基於這些參數選擇IFN適用對象後,應答率的提升幅度尚不夠顯著。本課題組前期研究發現血清中特定miRNAs組合和HBV剪接變異體的基線含量配合ALT有助於提高預測IFN應答的準確率,但仍需在大規模臨床隊列中進一步驗證及優化相關預測模型。此外,也應進一步研發新的更高效的可預測IFN療效的標誌物。近期建立的以染色質免疫共沉澱-高通量二代測序技術檢測乙型肝炎患者肝穿刺中cccDNA表觀修飾的技術可用於cccDNA活性的研究,並有望進一步用於預測療效。必須指出,雖然IFN發現至今已六十餘年,但對IFN誘生、調控及所致有效應答的機理認識依然有限,為此應進一步加強對IFN的基礎研究,包括抗病毒應答機制特別是IFN所致cccDNA沉默清除的研究,這將有助於針對性優化提高IFN的應答率和治療價值。
4.3 新型靶向cccDNA技術的研究
近年來出現了眾多新型抗HBV手段和技術,但目前尚未見可直接靶向cccDNA形成、轉錄和穩定性的候選藥物進入臨床試驗。相較靶向宿主分子的抗病毒策略,靶向病毒分子理論上在抗病毒的特異性與安全性上更有優勢。HBV核心蛋白和X蛋白被認為參與了cccDNA微小染色體的形成,同時與cccDNA轉錄調節相關,因此HBV核心蛋白和X蛋白的抑製劑被認為可能會對cccDNA的回補、轉錄活性和
圖1HBV cccDNA代謝清除的主要途徑及IFN和NAs治療對其的影響穩定性有乾預作用,這有待深入研究。此外,通過高通量篩選獲得直接針對cccDNA活性和穩定性的新型小分子化合物,以及研發免疫激活/免疫正常化的手段都將為沉默清除cccDNA提供新的理論和技術支撐。
5 結語
HBV cccDNA作為乙型肝炎慢性化和難以治癒的一大根源,其沉默清除是實現乙型肝炎治癒的關鍵,但當前NAs和IFN兩大治療手段均無法有效清除cccDNA和治癒乙型肝炎(圖1)。隨著對cccDNA轉錄代謝以及IFN效應和調控機制等認知的加深,新的策略和技術會不斷湧現。如何利用已有藥物設計和優化聯合/序貫治療方案[70]以及結合新型抗病毒手段開展多靶點聯合治療以提升沉默清除cccDNA的效率將會是研究重點之一。此外,近年來高通量測序、人工智慧和大數據等新興技術平台迅猛發展,將可能為乙型肝炎的精準化診療提供新的研究手段和解決方案。綜上,深化對cccDNA生物特性和抗病毒應答機制及影響因素的研究,不斷摸索優化臨床治療方案,將有望在更多的患者中實現乙型肝炎(功能性)治癒,而鑒於其困難度和複雜性,這有賴於多學科的交叉以及基礎、臨床和轉化醫學等多方面力量的共同努力和協作。
引證本文:ZHANG JM. Research status and challenges of HBV cccDNA[J]. J Clin Hepatol, 2019, 35(6): 1177-1180. (in Chinese)
張繼明. HBV cccDNA研究現狀與挑戰[J]. 臨床肝膽病雜誌, 2019, 35(6): 1177-1180.