強生旗下的楊森公司(Janssen Research & Development, LLC),旗下正在開發的JNJ-73763989(其他名稱:JNJ-3989 RNAi療法藥物)已進入人體第2期臨床研究階段。2020年10月14日,該公司更新了一項第2期臨床試驗設計方案,慢性乙型肝炎病毒感染肝內、外周免疫和病毒學標誌物變化的研究。

B肝在研新藥JNJ-3989,II期新晉研究,評cccDNA
這項研究指編號為NCT04585789,主要目的是,評估肝內B肝表面抗原(HBsAg)在基線檢查和治療中肝活檢對JNJ-3989為基礎的聯合治療的反應變化。聯用的藥物是恩替卡韋(ETV)或富馬酸替諾福韋艾拉酚胺(TAF),該研究預計納入24名受試者。本研究試驗設計方法如下:手臂乾預/治療,實驗組:手臂1,JNJ-73763989+JNJ-56136379+NA,受試者會接受JNJ-3989皮下注射(SC)每4周一次(最後一次注射在第44周);
JNJ-56136379片每日一次,核苷酸類似物(NA)治療(使用ETV或TAF片),每日一次,最多48周。手臂2:JNJ-73763989+NA,受試者將接受JNJ-73763989 SC注射,每4周一次(最後一次注射是在第44周),同時進行NA治療(ETV、TAF片),每日一次,最多48周。值得注意的是,本研究為聯合用藥,使用JNJ-73763989聯合恩替卡韋或替諾福韋艾拉酚胺,評估慢性B肝病毒感染者的肝內和外周免疫及病毒學標誌物變化影響。

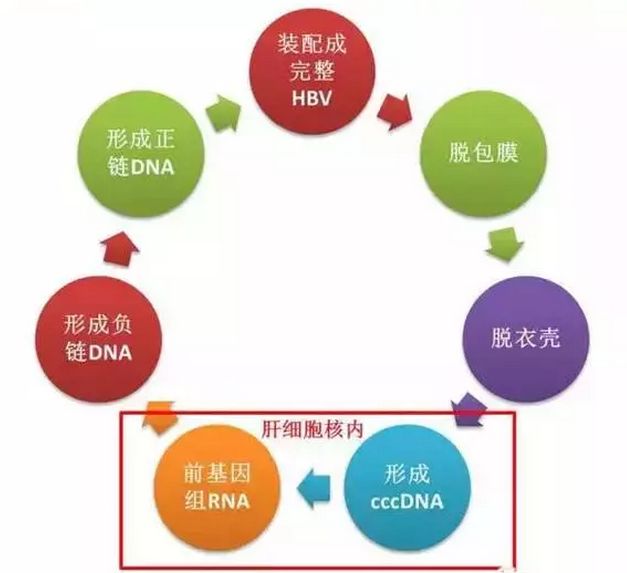
因此,本研究人員不僅需要觀察HBV-DNA、B肝表面抗原(HBsAg)試驗結果,還會觀察受試者肝內cccDNA和pgRNA水準變化。本研究尚未啟動,預計開始日期:2021年1月4日,預計初步完成日期:2022年11月18日,預計第2期整體完成日期:2023年7月。本研究主要結果指標包括:將報告基線和40周時,B肝表面抗原陽性肝細胞百分比與基線相比的變化。
次要結果指標包括:基線和第40周時,肝內免疫反應較基線變化;基線到第48周時,肝內B肝病毒各項參數,如B肝表面抗原和HBV-DNA與基線相比的變化(部門:IU/ml);基線至第48周時,肝內cccDNA、pgRNA水準與基線相比的變化;第72周時,B肝表面抗原血清清除率未重新啟動NA治療的受試者百分比;第96周時,(持續)降低、抑製和/或血清清除率的參與者百分比;第96周時,B肝表面抗原、e抗原血清轉化受試者百分比;

第96周時,有報告感染耀斑(病毒學、生化和臨床耀斑)的受試者百分比;第96周時,達到第1次B肝表面抗原血清清除的時間;第48周時,病毒學突破的受試者百分比;HBV特異性外周血T細胞反應的變化,出現不良事件和嚴重不良事件的受試者百分比等。本研究入選標準:18歲至65歲成人或老年人,不接受健康志願者,篩查前至少6個月記錄的B肝病毒感染;目前未接受治療的e抗原陽性者(大三陽),或在病毒學上(已使用NA)成為e抗原陰性者(小三陽)為抑製狀態等。
排除在第2期研究的標準:存在A、C、D或E型肝炎病毒感染的證據或篩查時為HIV-1、HIV-2感染證據;肝失代償證據,包括但不限於:門脈高壓、腹水、肝性腦病、食道靜脈曲張;篩查前6個月內或篩查時,經腹部超聲已有肝硬化或門靜脈高壓症病史或體征,肝細胞癌(HCC)或臨床相關腎功能異常等。目前,JNJ-73763989在國內外進行已開展人體臨床試驗,其中國內已可查詢到第1期臨床研究試點醫院:北京大學第三醫院(評估 JNJ-73763989 在健康中國成年受試者中的藥代動力學、安全性和耐受性 第1期)。

小番健康結語:以上試驗設計和登記信息編號為NCT04585789,研究為第2期尚未啟動預計將於2021年1月4日開始(上圖紅色方框為本試驗登記信息)。研究課題:一項第2期隨機、開放標簽、平行組、多中心研究,評估慢性B肝病毒感染患者對含有JNJ-73763989和核苷酸類似物的聯合治療方案,對慢性B肝病毒感染患者肝內和外周免疫和病毒學標誌物變化的影響。本研究將觀察這種聯合用藥對肝內cccDNA和pgRNA水準變化。返回搜狐,查看更多
責任編輯: