從發病機制到困惑和展望,關於AD你想知道哪些?
報導專家|福建醫科大學附屬協和醫院神經內科 陳曉春教授
整理|木彥
來源|醫學界神經病學頻道
阿爾茨海默病(AD),俗稱「老年癡呆症」或「老年性癡呆」,是一種隱匿起病、以認知功能進行性惡化為特徵的神經變性疾病,通常伴有日常生活能力受損和精神行為異常。
2015年,世界阿爾茨海默病報告顯示:
● 2015年新增各類癡呆患者990萬人次,約每3秒新發1例;
● 2015年全世界有4680萬人患有癡呆,這個數字幾乎每20年翻一番;
● AD患者的快速增長,對中國的經濟社會發展,帶來了很嚴峻的公共衛生問題。

在中華醫學會第二十一次全國神經病學學術會議上,來自福建醫科大學附屬協和醫院神經內科的陳曉春教授,對阿爾茨海默病的治療困惑與展望做了細緻的分析,內容非常精彩!
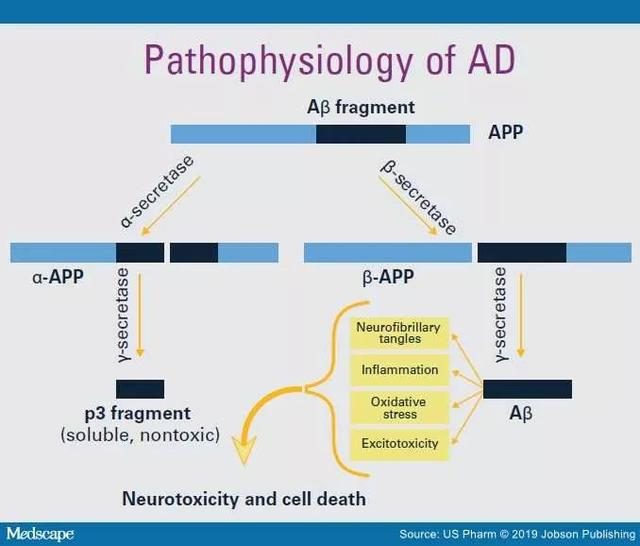
1AD發病機制的主要學說
包括膽鹼能學說、Aβ假說、tau蛋白學說、以及近年來大家比較關注的AD炎症假說。
● 膽鹼能學說:最為經典,也是目前各種治療的基礎,例如:膽鹼脂酶抑製劑、NMDA受體拮抗劑都是針對膽鹼能神經元的AD藥物。
● Aβ假說:是近25年的主流觀點,但是從很多3期臨床試驗來看,針對Aβ靶點開發的藥物,均以失敗告終,因此Aβ是AD的因還是果,仍需進一步驗證。
● tau蛋白學說:近年來受到越來越多的關注,特別是在新葯研發過程中,tau蛋白學說起了非常重要的作用。
● AD炎症假說:新興的理論,前景廣闊,有望對AD的治療帶來重大突破。

● 2018年5月,法國衛生部宣布,鑒於2011年、2016年,兩次對多奈呱齊進行藥效檢測,發現其不僅沒有療效,反而會產生強烈副作用,有較大風險,決定對其停止醫保支付。
● 事實上,13年來沒有一例新葯臨床試驗獲得成功。
● AD治療,目前幾乎「無葯可用」。
AD藥物研發失敗的可能原因:
1、晚髮型AD的確切病因和機理仍不清楚,新葯研發的關鍵作用靶點不明確;
2、臨床前研究使用的疾病模型很有限,沒能充分反映人類疾病客觀狀況;
3、臨床上缺乏非創傷性、有診斷價值的生物學標誌物,影響了AD診斷的準確性;
4、AD的病理生理過程進展緩慢,決定了臨床研究的持續時間需要很長。
3賈建平[1]教授團隊研究指出:● 中國重度AD患者中,多奈呱齊治療24周的有效性優於安慰劑,且安全性和耐受性良好;
● 多奈呱齊可用於治療中國重度AD患者。
DOMINO-AD[2]study結論:● 在中度或重度AD患者中,繼續使用多奈呱齊治療12個月,在臨床上還可有顯著的認知和功能獲益;
● 聯用美金剛比持續單用多奈呱齊治療可能獲益更多。
● 從機制上看,大多數藥物都是疾病病因治療藥物(63%),部分(23%)是認知改善藥物,少數(12%)是併發症治療葯(改善神經精神癥狀);
● 免疫治療的重要性越來越受到關注,單克隆抗體藥物在臨床研究中佔有主導地位;
● 60%的藥物都止步於三期臨床,2018年情況比2017年更為嚴重;
● 最近受Aβ靶點治療藥物失敗的影響,很多類似作用機制的藥物,均主動終止了三期試驗。
結論:在所有的癥狀改善葯中,通過拮抗5-HT6受體進一步增強腦中乙醯膽鹼的濃度的藥物,雖然在二期臨床中表現最好,但是三期臨床的數據並不理想。
磷酸二酯酶(PDEs)在神經突觸可塑性和學習記憶中起到重要作用,目前有6種磷酸二酯酶抑製劑進入臨床試驗,其中3個是PDE9抑製劑,2個是PDE4抑製劑,1個是PDE3抑製劑;目前有3個進入一期臨床試驗,3個進入二期臨床試驗,結果都很好。
新的靶點:tau蛋白在新葯當中,除了Aβ之外,Tau蛋白也受到越來越多的重視。
● tau蛋白擁有很多重要、但是機制不明的靶點,為新葯研發留足了想像太空;
● 針對降低tau蛋白聚集的幾個臨床藥物,目前均以失敗告終。
● 近來,7個針對tau蛋白免疫治療的臨床試驗,均在一期和二期中,取得了不錯的初步結果,有望取得突破。但是仍有問題待解決:
1、哪一個磷酸化的位點,才是抗原的重要靶點?
2、針對什麼地方的tau蛋白,是細胞內還是細胞外,可以發揮更好的作用?
3、tau蛋白降低到什麼程度?(tau本身是有生理功能的,並非降的越低越好)
4AD治療展望(1)未來的方向1:TREM2
TREM2基因位於人染色體6p21.1,是一個單次跨膜蛋白,屬於免疫球蛋白超家族的一類,有高度的組織和細胞特異性,在生理狀態下,主要表達與小膠質細胞,對自身免疫過程中的炎症反應具有重要的調節作用。
● 大樣本研究發現,TREM2的R47H和D87N的雜合突變,與AD患病風險顯著相關。部分研究提示R47H突變攜帶者AD發病年齡提前,也有報導提示R47H使 AD患者病程加速進展。


● TREM2能與Aβ體內直接結合;
● TREM2與Aβ結合,一方面介導了Aβ引起的小膠質細胞反應,另一方面,兩者相互作用,增強TREM2與其信號接頭蛋白DAP12的相互作用,並影響下遊信號傳遞。
(2)未來的方向2:ApoE
ApoE是分子量約為34KDa的糖蛋白。ApoE主要在肝臟和腦組織表達,在腦組織中,主要是由星型膠質細胞合成分泌,但在損傷或應激的情況下,神經元也能少量合成。
ApoE主要功能:調節脂質的轉運和太空分布;參與神經元的修復和再生;參與信號轉導過程。
ApoE4等位基因攜帶者,MRI可見腦萎縮,PET-CT可見葡萄糖代謝降低。
(3)未來的方向3:自噬
自噬是一種溶酶體依賴型的降解途徑,主要負責真核細胞內細胞器和長壽命蛋白質的降解。自噬包括分子伴侶介導的自噬、微自噬和巨自噬。
2018年5月,Beth Levine團隊[4]構建了一種突變小鼠,其自噬水準一直保持著高水準。通過改變了小鼠的自噬蛋白Beclin 1基因表達,從而抑製Beclin 1與BCL-2蛋白的結合。
(4)未來的方向4:腦表面淋巴管迴流障礙
淋巴管在大腦「清除垃圾「的過程中,扮演了重要的角色,而淋巴管的功能失常,則會引起一系列衰老相關的大腦疾病。
2018年7月,nature雜誌發表了一篇文章[5],指出腦膜淋巴管破壞後,小鼠的學習記憶功能將受損,此與Aβ清除障礙相關,使關於腦膜淋巴管迴流障礙的研究,是未來AD治療的一個重要方向。
(5)未來的方向5:組蛋白乙醯化
乙醯化是一種常見的蛋白質翻譯後修飾,一般情況下組蛋白的乙醯化,有利於DNA與組蛋白八聚體的解離和核小體結構鬆弛,激活基因的轉錄。在細胞核中,組蛋白去乙醯化酶1(HDAC1)與組蛋白乙醯化轉移酶,HAT共同調控組蛋白乙醯化的動態平衡,對染色體的結構修飾和基因表達調控發揮著重要作用。
2018年8月,發表在Developmental Cell的文章[6]指出,HDAC1存在於神經元的軸突中,當變性信號被激活時,HDAC1通過軸突將資訊傳導物質傳導到神經元的胞體,引起神經源損害,與AD密切相關。5小結● AD的病因以及發病機制並未完全闡明,且缺乏有效的治療藥物;
● AD治療遭遇很大困惑,經典藥物的療效遭遇質疑;
● AD治療新葯研發頻頻失敗,但有一些新靶點和機制的藥物引起關注;
● 與AD病理生理機制密切相關的因素,均有可能成為AD治療潛在的藥物作用靶點。
參考文獻:
1. Jia J, Wei C, Jia L, Tang Y, Liang J, Zhou A, Li F, Shi L, Doody R (2017) Efficacy and Safety of Donepezil in Chinese Patients with Severe Alzheimer"s Disease: A Randomized Controlled Trial. J Alzheimers Dis 56 (4):1495-1504
2. Knapp M, King D, Romeo R, Adams J, Baldwin A, Ballard C, Banerjee S, Barber R, Bentham P, Brown R, Burns A, Dening T, Findlay D, Holmes C, Johnson T, Jones R, Katona C, Lindesay J, Macharouthu A, McKeith I, McShane R, O"Brien J, Phillips P, Sheehan B, Howard R (2017) Cost-effectiveness of donepezil and memantine in moderate to severe Alzheimer"s disease (the DOMINO-AD trial). International journal of geriatric psychiatry 32 (12):1205-1216
3. Zhao Y, Wu X, Li X, Jiang L, Gui X, Liu Y, Sun Y, Zhu B, Pi?a-Crespo J, Zhang M, Zhang N, Chen X, Bu G, An Z, Huang T, Xu H (2018) TREM2 Is a Receptor for β-Amyloid that Mediates Microglial Function. Neuron 97 (5):1023-1031.e1027
4. Fernández á, Sebti S, Wei Y, Zou Z, Shi M, McMillan K, He C, Ting T, Liu Y, Chiang W, Marciano D, Schiattarella G, Bhagat G, Moe O, Hu M, Levine B (2018) Disruption of the beclin 1-BCL2 autophagy regulatory complex promotes longevity in mice. Nature 558 (7708):136-140
5.Da Mesquita S, Louveau A, Vaccari A, Smirnov I, Cornelison R, Kingsmore K, Contarino C, Onengut-Gumuscu S, Farber E, Raper D, Viar K, Powell R, Baker W, Dabhi N, Bai R, Cao R, Hu S, Rich S, Munson J, Lopes M, Overall C, Acton S, Kipnis J (2018) Functional aspects of meningeal lymphatics in ageing and Alzheimer"s disease. Nature 560 (7717):185-191
6. Pathak A, Stanley E, Hickman F, Wallace N, Brewer B, Li D, Gluska S, Perlson E, Fuhrmann S, Akassoglou K, Bronfman F, Casaccia P, Burnette D, Carter B (2018) Retrograde Degenerative Signaling Mediated by the p75 Neurotrophin Receptor Requires p150 Deacetylation by Axonal HDAC1. Dev Cell 46 (3):376-387.e377