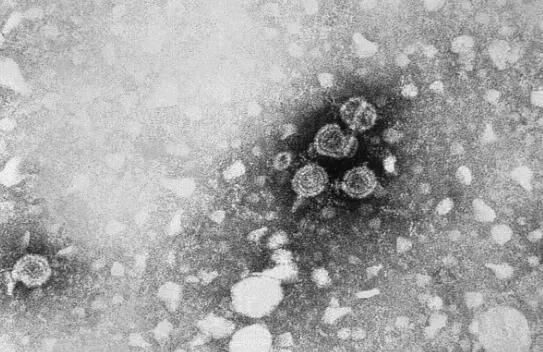
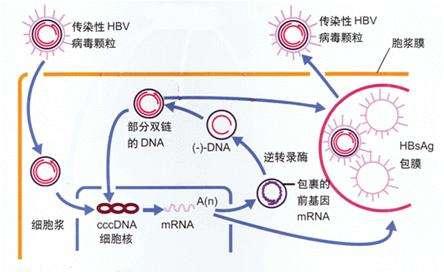
B肝病毒(HBV),是人類病原體中較為成功之一,其對全球範圍內人類健康構成重大威脅。目前,慢性B肝(CHB)患者的藥物可以控制HBV複製而不消除HBV感染。為了開發治療慢性B肝病毒感染者新療法藥物,提高對B肝病毒生命周期的認識才是至關重要的。

B肝乾預生命周期前景,ERGIC-53凝集素,望成為細胞靶點
其實,B肝病毒與所有病毒一樣,HBV需要利用細胞的分子機制來繁殖複製。通過劫持宿主細胞過程尤其適合B肝病毒,因其DNA基因組大小約有3kb,是目前科學界已知最小的病毒基因組之一。HBV,是一種嗜肝的包膜病毒,通過蛋白啟動的逆轉錄進行複製。它的基因組僅包含4個重疊的開放閱讀框(ORF),編碼聚合酶/逆轉錄酶(Pol)、衣殼形成核心蛋白及其同源分泌的前核心蛋白,以及調節性X蛋白和3個相關的包膜蛋白。
HBV的發現已有幾十年,科學家對深入認識其,識別和鑒定細胞和致病成分之間的相互作用,對於抗病毒藥物開發發展至關重要。來自德國奧古斯都普拉茨市約翰尼斯古騰堡大學醫學中心病毒學研究所及德國美因茨研究人員,根據以上對HBV的認識,於2020年8月12日,在Cells雜誌上發表了一項關於乙型肝炎病毒利用ERGIC-53與COPII結合退出細胞研究,研究人員指出,這項研究可以說明乾預B肝病毒生命周期的治療前景(全球以HBV生命周期為靶點研發新藥)。

因為當前全球基於B肝病毒生命周期而開發不同靶點新藥,這項研究結果表明,B肝病毒不僅利用內質網膜作為蛋白質合成的平台,且還破壞了B肝病毒傳播的內質網輸出機制。我們在這裡確定了ERGIC-53,它是一種早期胞外途徑中的凝集素樣貨物受體,以及不同的COPII組分是引導HBV病毒顆粒排出的關鍵宿主因子。
德國研究人員認為,當B肝病毒感染肝細胞時,其不僅產生包膜的子代病毒,並且還產生空包膜的亞病毒顆粒(SVPs),在與病毒相比時,這種病毒顆粒分泌過多,被認為能中和宿主對感染性HBV的免疫反應。通過分析球形SVP通過細胞分泌途徑的運輸,我們先前發現病原體篡奪COPII囊泡形成機制的不同組成部分,從而使球形SVP宿主細胞退出。
有證據表明,HBV球形亞病毒與病毒顆粒的販運和出口途徑可能不同,我們回顧了在HBV複製的HuH-7肝細胞培養中的COPII干擾實驗。觀察到,HBV病毒釋放與SVP分泌具有相同的COPII選擇性,因為它需要一個功能性的Sar1 GTPase,以及Sec24A和Sec23B亞型。儘管SVP過量生產,但在伴隨SVP形成的突變消融後,仍能夠保持有效的HBV分泌。因此,我們推斷病毒包膜本身是需要COPII引導的ER輸出機制的。
然而,令人驚訝的是,我們沒有檢測到超過內質網的HBV包膜,因為它既沒有與ERGIC或高爾基體特異性結構共定位。相反,被膜以一種局限的新月形結構(CS)的形式積聚在核周ER區。為了尋找可能的差異,我們在此發現細胞ERGIC-53凝集素對HBV病毒顆粒釋放至關重要,但對HBV球形SVP分泌是不必要的。ERGIC-53,是一種內質網輸出受體,可以通過COPII和COPI依賴途徑在ER、ERGIC和順式高爾基體之間循環。

例如,當前基於RNAi干擾類藥物這項靶點而開發B肝新藥,我們就在本研究中注意到,RNAi介導的ERGIC-53沉默可顯著抑製HBV的排出,但並不影響包膜蛋白合成、病毒複製和核衣殼形成。我們發現,即使B肝病毒核衣殼的包膜在ERGIC-53沉默細胞中,也沒有受到損害,這一發現有力地表明,凝集素在HBV轉運中作用,而不是在組裝中的作用。

小番健康結語:這項研究人員包括麗莎·澤耶諾西德、塔吉娜·德林和萊茵希爾德·邦奇,來自德國奧古斯都普拉茨市約翰尼斯古騰堡大學醫學中心病毒學研究所及德國美因茨研究人員,關於乙型肝炎病毒利用ERGIC-53與COPII結合退出細胞,發表在Cells雜誌上。這項研究首次證明了細胞ERGIC-53凝集素在HBV致病生命周期中的重要作用。ERGIC-53與COPII的選擇性組件(包括Sec24A、Sec23B和Sar1)協同工作,以推動HBV-ER。
病毒SVP的分泌繞過了這種轉運因子的需要,這意味著ERGIC-53類似於HBV病毒與球形亞病毒顆粒時空輸出途徑分離的檢查點。HBV-ERGIC-53相互作用的特徵,確定病原體衍生的N-聚糖是凝聚素的一個關鍵但不是唯一的配體。事實上,人類對ERGIC-53或其功能的喪失有很好的耐受性,這使得這種蛋白成為抗病毒治療藥物乾預的一個有吸引力的細胞靶點(2020年8月12日 Cells)。返回搜狐,查看更多
責任編輯: