2019年3月31日/醫麥客 eMedClub/--在腫瘤治療研究中,腫瘤乾細胞(CSC)應該是一種不容忽視的存在。它具有自我更新和分化的能力,可在實體瘤中分化產生異源腫瘤細胞。這類細胞被認為與腫瘤的轉移、複發以及對常規療法(包括放療和化療)的抗性有關。
這些特性部分源於CSC的信號傳導途徑以及它們在腫瘤微環境(TME)的駐留。我們應該知道,腫瘤微環境具有細胞因子水準升高、缺氧、酸性pH以及存在慢性炎症和癌症相關成纖維細胞(CAF)的特徵。
可以說,CSC是新型抗腫瘤療法中一個有前途和吸引力的方向。目前,已經設計了針對CSC的不同腫瘤治療策略,包括抑製與治療抗性相關的自我更新或分化通路、靶向CSC細胞表面標誌物、通過抑製糖酵解和調節線粒體進行代謝控制,以及基於miRNA的策略阻止癌症乾性。
在最近發表於Stem Cells上,題為Concise Review: Targeting cancer stem cells and their supporting niche using oncolytic viruses的文章,就重點論述了使用溶瘤病毒靶向CSC的策略。


近來,溶瘤病毒越來越多地進入我們的視線。
而為什麼溶瘤病毒可以應用於腫瘤治療呢?為什麼溶瘤病毒作為單一療法或者組合療法可以提高腫瘤治療作用呢?
OV的腫瘤細胞選擇性
簡單來說,腫瘤環境中腫瘤細胞、免疫細胞、基質細胞以及血管系統的相互聯繫與作用形成了有助於病毒感染的免疫抑製環境。
減毒的溶瘤病毒(OV)在正常細胞中是無害的,而在腫瘤中維持毒力,通過利用腫瘤細胞特異性信號通路,包括致癌通路上的異常信號傳導或腫瘤抑製通路上的缺陷。OV是具有天然內向性的病毒,已經被設計開發在腫瘤細胞中選擇性複製。


腫瘤微環境中的信號聯繫
對於幾種OV,驅動腫瘤細胞選擇性的關鍵因素之一是內源性干擾素(IFN)信號傳導的缺陷。IFNs是一類細胞因子,可激活抗病毒效應物的表達,促進抗原呈遞,激活免疫細胞,並對抗惡性增殖。作為致癌作用的最初步驟之一,永生化過程也與IFN-I型信號傳導的破壞有關。這一過程可能使得癌細胞通過激活p38絲裂原活化蛋白激酶信號,來規避干擾素介導的生長抑製作用。
腫瘤微環境中細胞因子介導的相互聯繫與作用不僅進一步抑製腫瘤細胞中的IFN信號傳導,還抑製血管內皮細胞和CAF中的IFN信號傳導。同時,有研究表明,腫瘤細胞分泌的血管內皮生長因子(VEGF)促進腫瘤血管形成,並抑製內皮細胞的抗病毒反應,使其易受OV感染。
OV驅動IFN信號傳導以產生溶瘤作用
總的來說,腫瘤中抗病毒作用的損害使得微環境對病毒溶瘤作用高度敏感。
OV具有通過腫瘤細胞(經病毒感染的內在免疫識別細胞)和病毒的免疫細胞來驅動IFN信號傳導的能力。現在已經充分證實了,樹突細胞(一種關鍵抗原呈遞細胞)中的I型IFN信號傳導對於啟動T細胞並引發殺死腫瘤細胞是至關重要的。這樣,也就不難理解,對於發揮OV功效而言,在腫瘤中驅動IFN產生是至關重要。
那麼針對CSC呢?是什麼情況呢?
一些研究已經證明OV可以在CSC中感染和/或複製。而且有趣的是,研究發現IFN-I型信號通路抑製了三陰性乳腺癌(TNBC)中的CSC特性,IFN-β被認為是TNBC的潛在治療選擇。後來的一項研究也證實,CSC表型與IFN信號傳導之間存在負相關。這些研究都反映,腫瘤微環境中OV驅動的IFN產生可抑製CSC特性。
最近一項使用寨卡病毒(ZIKV)作為溶瘤病毒療法以靶向人和小鼠膠質母細胞瘤腫瘤乾細胞的研究,進一步證實了這一點。Zhu及其同事證明,使用ZIKV感染,將優先感染膠質母細胞瘤乾細胞(GSCs),而不是分化的膠質瘤細胞(DGCs)和正常的人類神經細胞。而且,對感染細胞的RNA測序表明,ZIKV感染的GSC選擇性是因為IFN信號傳導的缺陷。
利用CSC的細胞表面標誌物作為OV感染的CSC特異性的選擇靶點
除了IFN缺陷,CSC的細胞表面標誌物可作為增加OV感染的CSC特異性的選擇靶點。已經發現了幾種CSC的細胞表面標誌物,但是,這些細胞表面標誌物通常在人類胚胎或成體乾細胞也表達。最早鑒定且被頻繁研究的CSC表面標誌物之一是CD133,一種膜蛋白,在造血乾細胞以及幾種不同類型的CSC中表達。
而將病毒包膜蛋白與單鏈可變片段(scFv)抗體融合,可以促進某些病毒的重新靶向。例如,Buchholz及其同事通過將麻疹病毒包膜蛋白與CD133抗體融合,將麻疹病毒重新靶向CSC。基於類似的抗體包膜蛋白融合的方法,已經產生了靶向CD133的腺病毒和靶向上皮細胞粘附分子(EpCAM)的皰疹病毒。
Hanauer及其同事在包膜融合蛋白中使用了稱為改造的錨蛋白重複蛋白(DARPins)的抗體類似物,產生了靶向EpCAM的麻疹病毒。在後一項研究中,研究者還利用DARPins的多功能性,構建了靶向EpCAM和HER2的雙特異性麻疹病毒。
前面也提到,CSC的某些細胞表面標誌物也存在於其他細胞,所以基於包膜融合方法的臨床應用還需要其他策略,例如利用腫瘤特異性啟動子來進一步驅動腫瘤特異性。
OV聯合療法
值得注意的是,分化的腫瘤細胞去分化為CSC,這強調了消除所有腫瘤細胞的必要性。最近的研究工作,揭示了OV作為聯合療法的遞送平台以及聯合療法的一部分的效用。接下來,我們就來看看OV與其他腫瘤療法聯合以靶向CSC和腫瘤微環境的潛在效用。
與檢查點抑製劑聯合
CSC通過多種不同機制產生,這些機制可能涉及上皮間質轉化(EMT)的激活。有趣的是,具有EMT表型的CSC由於PD-L1表達升高而具有較低的免疫原性。可以說,PD-L1在CSC表面普遍存在顯示了一種治療途徑——OV與免疫檢查點抑製劑(ICI)聯合。


腫瘤乾細胞及其周圍的免疫抑製環境
這一聯合療法,在一系列惡性腫瘤的臨床前和臨床研究中被證明是有效的,如難治性TNBC 、黑色素瘤和神經膠質瘤。聯合療法中應用到的OV平台包括腺病毒、麻疹病毒、痘苗病毒、甲型流感病毒和粘液瘤病毒。病毒編碼檢查點抑製劑這一療法通常比單獨治療或組合治療更有效,並且表現出改善的安全性。
與BiTE聯合
我們知道,在缺氧TME中,T細胞受到抑製而CSC快速增殖。缺氧誘導的MHC下調是一種免疫逃逸機制,因為MHC是T細胞識別和殺傷腫瘤細胞所必需的。解決該問題的一種策略是使用雙特異性T細胞接合物(BiTE),其能夠介導T細胞以非MHC依賴性的方式識別和殺傷腫瘤細胞。
BiTE由靶向T細胞標誌物CD3和特定腫瘤相關抗原(TAA)的連鎖scFv抗體組成。 BiTE使腫瘤細胞和附近T細胞之間形成假免疫突觸。但是,臨床開發中的BiTE仍然存在許多挑戰,如全身給葯相關毒性、在實體瘤中如何克服TME並達到有效局部濃度。
使用OV作為遞送載體將BiTE分泌到僅需要皮摩爾濃度的準確位點可能是非常有效的策略。實際上,已有研究表明,表達於溶瘤腺病毒、麻疹病毒和痘苗病毒骨架的BiTE帶來了更好的結果,同時脫靶毒性降低。
顯然,理想的TAA是在CSC和腫瘤細胞上都表達。EpCAM是一個很好的例子,它是一種在缺氧條件下上調的表徵良好的乾細胞標誌物。Freedman及其同事表明,儘管在免疫抑製微環境,表達EpCAM-CD3 BiTE的腺病毒可激活組織活檢樣本中的T細胞以殺死腫瘤細胞。


OV分泌的雙特異性抗體誘導腫瘤細胞死亡
與CAR-T聯合
想必對於腫瘤免疫新型療法CAR-T,在此不必贅述。鑒於 OV將「冷」免疫抑製性腫瘤轉變為「熱」炎性腫瘤的能力,聯合這兩種療法似乎是合乎邏輯的。一些研究已經證明了這兩種療法的聯合可促進CAR-T細胞的活性。
腫瘤逃逸CAR-T細胞的關鍵機制之一是腫瘤細胞中抗原表達降低或喪失。基於OV的策略以克服這種逃逸機制是在OV中編碼靶向TAA的CAR,並利用OV驅動TAA表達的增加。

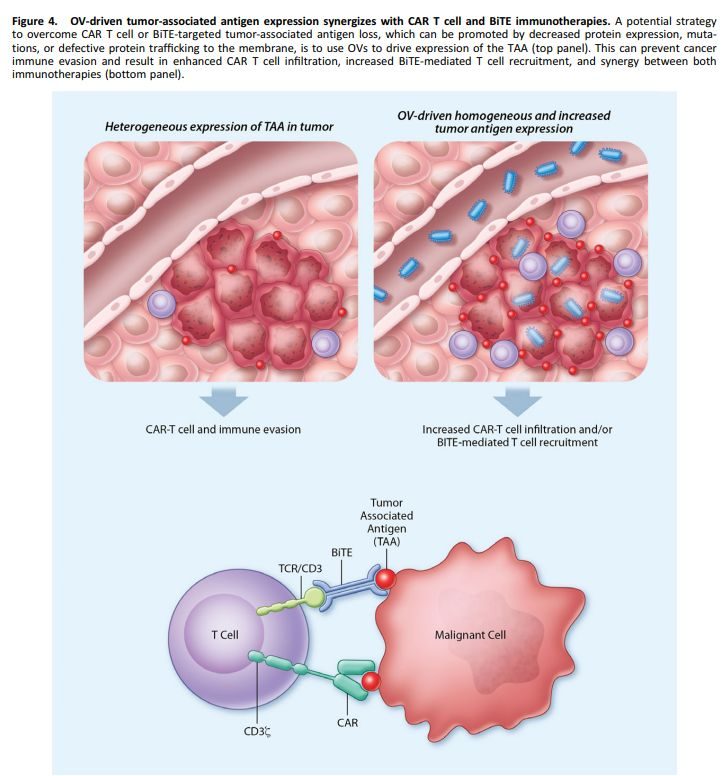
與CAR-T和BiTE免疫療法聯合時,OV驅動腫瘤相關抗原表達
參考出處:
點擊圖片了解詳情


點擊下方,搶先報名參與大會!