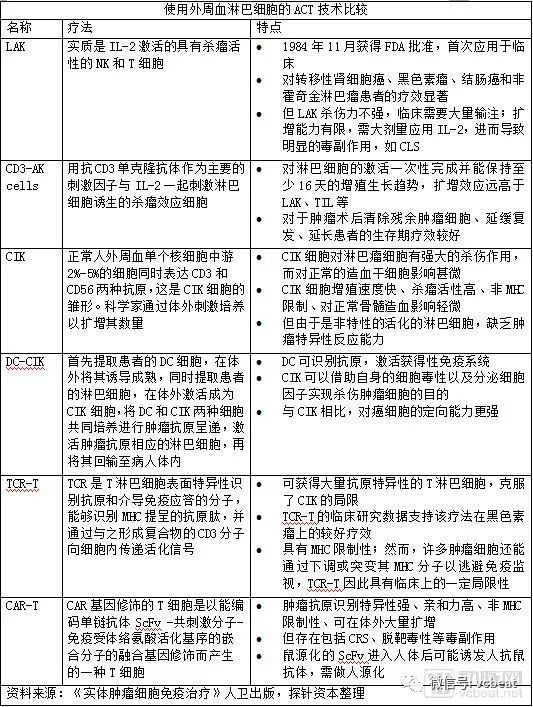
本文由醫麥客原創,歡迎分享,轉載須授權
2019年6月20日/醫麥客 eMedClub/--Triumvira Immunologics是一家私營生物製藥公司,致力於開發一種工程T細胞攻擊腫瘤的新平台。6月18日,該公司宣布美國食品藥品管理局(FDA)和加拿大衛生部已經批準TAC01-CD19的研究新葯(IND)和臨床試驗申請(CTA),以治療複發/難治性CD19陽性B細胞惡性腫瘤。預計I/II期臨床試驗(TACTIC-19)將於2019年第三季度啟動。

TAC01-CD19包含通過慢病毒轉導進行基因工程改造以表達CD19 T細胞抗原偶聯劑(TAC)的自體T細胞。臨床前數據表明,TAC01-CD19具有高效且副作用小的潛力。
Triumvira的總裁兼首席執行官Paul Lammers博士表示:「獲得美國FDA和加拿大衛生部對這種新方法的首次IND許可,使我們得以成為一家臨床階段生物技術公司,這也表明了我們將這種創新治療帶給患者的承諾。TAC01-CD19將在美國和加拿大的五個領先淋巴瘤臨床研究中心進行測試。基於其臨床前概況,TAC01-CD19有可能代表著在T細胞治療方面的重大進步。」

TAC具有優於CAR和TCR方法的潛力
Triumvira由加拿大麥克馬斯特大學(McMaster University)的Jonathan Bramson博士和Bloom Burton&Co於2015年共同創立,旨在開發出更安全,比目前的細胞療法癌症治療(包括CAR-T和TCR-T)更有效的新型T細胞療法。

TAC(T細胞抗原偶聯劑)是包含多個蛋白質結構域的雜合分子,其將腫瘤靶向能力與T細胞自身的激活機制相結合。
具體設計包括三個部分:第一部分為胞外抗原結合域(抗體片段或者DARPin等)、第二部分為胞外anti-CD3 scFv(單鏈抗體)、第三部分為CD4跨膜結構域連接蛋白激酶LCK。

▲ TACs的結構包括三個部分(圖片來源:biotuesdays)
一旦整合到患者自身的T細胞中:
第一個結構域便通過結合腫瘤特異性靶標促進TAC-T細胞對腫瘤細胞的識別;
-
第二個結構域將TAC分子連接到內源性天然T細胞受體(TCR);
TAC分子通過CD4共受體結構域(第三個結構域)錨定在膜中,這為TAC增加了共受體功能。
通過腫瘤靶標和TCR結合能力以及共同受體整合的組合,TAC誘導TCR信號傳導途徑的天然活化,並因此誘導T細胞介導的腫瘤細胞殺傷。
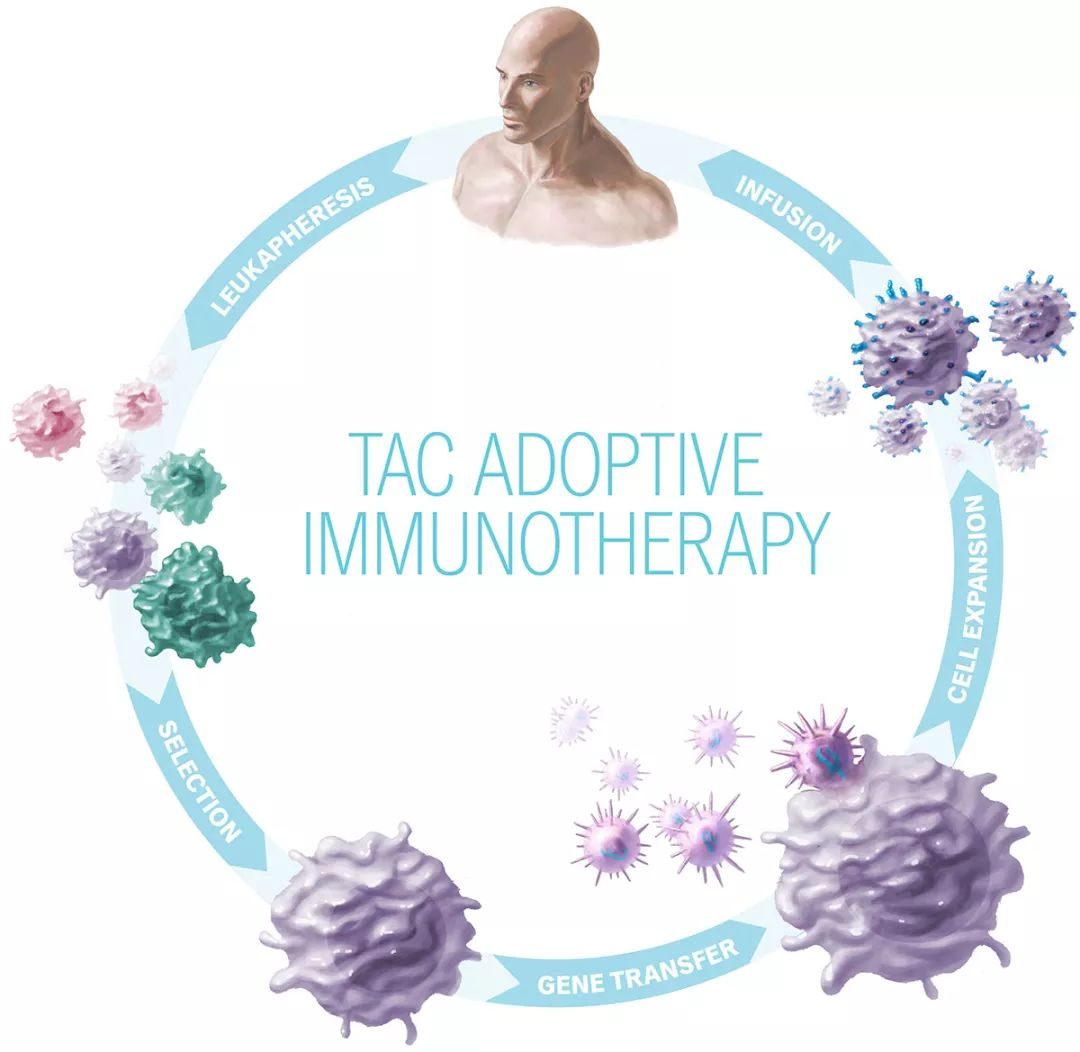
TAC-T治療過程與傳統的CAR-T療法類似,從患者身上採集白細胞,隨後利用基因工程將TAC受體插入T細胞,並指導它們識別某些癌細胞表面發現的蛋白質。擴增後,這些重編程的TAC-T細胞回輸至患者體內,在那裡它們可以發現癌細胞並殺死它們。

CAR-T細胞在各種白血病和淋巴瘤中顯示出令人印象深刻的功效,但伴隨著顯著的、有時是致命的毒性。大約30%接受CAR-T治療的患者會出現嚴重的細胞因子釋放綜合征(CRS),需要進入重症監護病房。此外,嚴重的神經毒性也很常見,可能與細胞因子增加有關,這種情況也可能是致命的。
這些毒性可能是由繞過正常的T細胞活化途徑引起的。由於TAC本身不具有任何信號傳導能力,T細胞活化僅由內源性天然TCR介導。因此,TAC利用完整的T細胞抗癌潛力,同時保留細胞的自然控制和安全機制,有可能提供更好的T細胞活化調控。TAC分子可以通過特定的腫瘤靶標和其他細胞外或細胞內部分進行定製,為特定腫瘤類型進行優化和微調。
某種意義上,TAC更類似於在腫瘤抗原與TCR之間搭建的「橋樑」,在利用TCR的天然機制的同時,繞過了主要組織相容性複合物(MHC)的限制。


▲ TAC與CAR、TCR對比(圖片來源:Triumvira、biotuesdays)
目前,基於該技術平台的自體細胞療法正在開發中,但其同時也具有同種異體(off the shelf)應用的潛力。

治療實體瘤的潛力
雖然CAR-T方法對血液系統惡性腫瘤非常有效,但它們未能在實體瘤中產生良好結果,並且通常受到嚴重/致死毒性的阻礙。這些臨床結果可能是由於CAR提供的是非天然信號。CAR的非天然信號傳導性質導致不受控制的T細胞活化,隨後在實體瘤的惡性腫瘤微環境中快速耗盡。
TCR方法使T細胞能夠識別特定靶標並使用天然信號傳導,這在實體瘤中可能是更可行的。然而,TCR提供有限的腫瘤細胞識別,因為其依賴於MHC結合,其在癌細胞中經常不存在或下調。
TAC代表了CAR和TCR方法的重大進步,因為TAC能夠更有選擇性地識別腫瘤細胞,通過天然TCR激活T細胞,利用天然活化和調節機制,以及缺乏強直性信號,因此T記憶細胞持續存在(而不是耗盡)。
因此,TAC-T細胞有望誘導一種可控的腫瘤特異性反應,降低毒性,並應用於實體瘤的治療。
Triumvira在臨床前研究中對TAC技術進行了廣泛測試,並證明TAC-T細胞相比CAR-Ts來說,可以攜帶記憶T細胞標記,並有效侵入實體瘤。這些特徵有助於完全消除實體瘤,並且在體內沒有毒性。
去年在國際著名期刊Nature Communications上,該公司描述了TAC的作用機制,結果顯示:TAC-T細胞能夠在體外產生強效抗原特異性的細胞因子以及細胞毒性,並且在各種異種移植物模型(包括實體瘤和血液腫瘤)中的強抗腫瘤活性。
Nature重磅:比CAR/TCR-T還牛!TAC-T細胞治療實體瘤,彰顯強效抗腫瘤活性和安全性丨醫麥黑科技

Triumvira管線分析
TAC01-CD19是Triumvira公司首個進入臨床的TAC-T細胞療法,針對實體瘤適應症的TAC01-HER2和TAC01-ROR1預計也將在2020年獲批IND。在其管線中,還包括未披露靶點的同種異體TAC-T療法。

▲ 研發管線(圖片來源:Triumvira)
CD19和DLBCL
CD19是一種B細胞標誌物,在瀰漫性大B細胞淋巴瘤(DLBCL)等B細胞惡性腫瘤表面大量表達。DLBCL是一種非霍奇金淋巴瘤(NHLs)亞型。預計2018年美國約有2.6萬名DLBCL患者。儘管在過去的幾年裡,治療方法有了顯著的改善,但是大約45%的DLBCL患者死於疾病進展或非癌症原因。
BCMA和多發性骨髓瘤
漿細胞的存活受B細胞成熟抗原(BCMA)的調控。多發性骨髓瘤是一種漿細胞疾病,儘管最近治療進展顯著,仍然是一種無法治癒的疾病。預計2018年美國約有3.1萬名多發性骨髓瘤患者。
HER2
人類表皮生長因子受體2 (HER2)與幾種惡性腫瘤相關,例如62%的多發性膠質母細胞瘤(一種典型的無法治癒的腦腫瘤)患者和20%的乳腺癌患者。它在其他幾種癌症中也有表達。預計2018年美國約有1.6萬名多發性膠質母細胞瘤患者,HER2陽性乳腺癌將影響約5.4萬名患者。
ROR1
受體酪氨酸激酶ROR1在多種癌組織中表達,包括約53%的非小細胞肺癌、33%的乳腺癌、94%的結直腸癌、15%的胰腺癌和61%的卵巢癌。ROR1的高表達已被證明可降低總生存率。以ROR1為靶點提供了巨大的市場機會。

結語
去年,TAC-T相關臨床前數據一經報導,便引起了行業熱議。隨著細胞治療領域迅速進展,稱得上是真正突破性的成果會越來越少,每一步小突破都可能是變革的基石。此次,這款下一代細胞療法正式獲批進入臨床,我們期待下一次報導的會是積極的臨床數據。
參考出處:
https://finance.yahoo.com/news/triumvira-immunologics-announces-clearance-ind-110000515.html?guccounter=1&guce_referrer_us=aHR0cHM6Ly93d3cuZ29vZ2xlLmNvbS8&guce_referrer_cs=E4ujKhc0YNwKOFfzr7CfHA

醫麥猛爆料
大突破-Zolgensma?獲批 | ASCO | 地西他濱聯合PD-1 | 中國最大License-in | 日本CAR-T療法獲批上市 | 一天製造CAR-T細胞 | CRISPR美國首次人體試驗 |TAC療法橫空出世 | 美國CAR-T治療納入醫保 | 升級版PD-L1/TGF-β雙抗 | PD-1:K葯、O葯、T葯、B葯、I葯 | 中國首個異基因乾細胞產品獲批 |
19家頂級CAR-T公司PPT(上)|(下) | 20篇腫瘤免疫高引綜述 | 40篇細胞/基因治療人氣文獻 | 30+篇細分領域深度報告 | 70篇精選誠意大禮包 | 女王專屬大禮包 | 硬核CAR-T大禮包 | 硬核腫瘤免疫大禮包 | 基因治療「錦鯉」大禮包 |