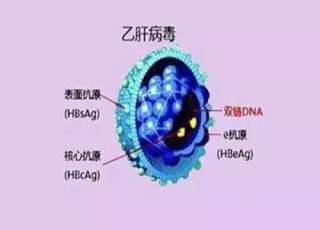
全球約2.4億人感染了HBV和HCV。其感染的慢性化是治療中最棘手問題和肝癌發生的重要原因,但具體機制還有待完善。外泌體的發現和研究,為HBV/HCV感染和慢性化提供了新的視角。外泌體是由多種細胞在正常及病理情況下分泌的一類直徑約為30~150 nm的小囊泡,具有脂質雙層膜結構。2007年以來,研究發現外泌體中含有細胞特異的蛋白、脂質和核酸,特別是微小RNA(microRNA,miRNA),可作為信號分子隨外泌體傳遞給其他細胞從而改變它們的功能。有報導肝炎病毒的所有成分都可被外泌體傳遞。Yang等鑒定發現,HBV感染者外周血血清分離的外泌體中含有大量HBV成分,包括HBV DNA和RNA,其中HBsAg和HBeAg分別可達1.9~5.4 ng,5.2~1.5 nCU。這些成分可隨外泌體傳染給自然殺傷(natural killer,NK)細胞,從而抑製NK細胞功能,引起γ-干擾素(interferon-γ,IFN-γ)表達下降。Kouwaki等研究證明,外泌體中的HBV DNA/RNA可以刺激人巨噬細胞THP-1中ΜLBP2的表達增強,最終影響IL-12的分泌。
因此,外泌體可能已經成為HBV的一種重要傳播介質。本文將以HBV和HCV感染者血清外泌體中的標誌物存在情況及其對檢驗結果的影響進行分析,探討檢測血清外泌體肝炎標誌物的意義。
外泌體的生成和分泌
20世紀70年代,Crawford就發現,除了可溶性的分子,細胞外囊泡是細胞之間通訊的重要手段之一。基於細胞外囊泡的不同來源,Kooijmans將之分為幾種類型:細胞凋亡後產生的50 nm至5 μm的凋亡小體;細胞膜向外出芽裂變形成的50~1 000 nm的微囊泡;細胞膜向內出芽裂變形成的40~100 nm外泌體。細胞外囊泡都可以以包裹的方式將細胞內容物納入囊泡中。
細胞內吞過程中形成的早期內涵體,經內部酸化再成熟為晚期內涵體,之後通過內向出芽方式,包裹選擇性負載的蛋白、核酸等物質形成外泌體的前體——管腔囊泡(intraluminal vesicles,ILVs)。晚期內涵體內包含多個ILVs後,即成為多胞體(multivesicular body,MVB),大部分MVB被運送至溶酶體後導致MVB的內含物降解,而小部分MVB的膜表面有CD63、溶酶體跨膜蛋白1(lysosomal membrane protein,LAMP1)、LAMP2等,可介導其與細胞質膜融合,在細胞內Rab蛋白牽引下,MVB與細胞表面融合併向胞外釋放外泌體。
作為細胞間通訊的重要手段,外泌體中包涵的核酸和蛋白質可以通過外泌體與靶細胞的結合,被傳遞而發揮作用。研究表明,釋放到細胞外的外泌體,既可分布於分泌細胞的周邊,也可通過多種途徑進入血液、尿液、唾液、腦脊液等多種體液中。其與靶細胞的相互作用主要有兩種方式:(1)特異性作用:通過特異性抗原抗體作用相互識別;(2)非特異性作用:靶細胞通過細胞內吞作用將外泌體吞入胞內。
這提示外泌體是細胞內容物釋放或分泌的新機制。有些分子是以可溶性方式通過轉運高爾基體網分泌到細胞外的;而所有分子,包括分泌和非分泌性核酸和蛋白質,都可通過外泌體釋放到細胞外。
細胞外HBV和HCV標誌物的來源
在肝炎病毒複製、包裝和釋放的過程中,目前理論仍然停留在內質網-高爾基體時代。長期以來,人們認為,HBsAg和HBeAg也是通過內質網-轉運高爾基體網被釋放出細胞外的。但多項研究表明,HBsAg和HBeAg並不能與內質網和高爾基體共定位,超微電鏡也發現這些抗原所在的膜室結構標誌物並不同於內質網或高爾基體。更有意義的是,Abdulkarim等最新發現HBsAg主要聚集於核周隙部位,在動力蛋白2存在的情況下才能分泌出細胞外;如果動力蛋白2突變,細胞外HBsAg則大量減少。同時,如果用U18666A抑製了MVB的合成,也會看到HCV的細胞外釋放減少,卻在胞內集聚50倍以上。這些都提示,HbsAg、HbeAg,甚至病毒DNA和RNA的分泌途徑經過了外泌體。
目前,尚無證據表明動力蛋白2是外泌體相關的標誌物,或者是外泌體的分子馬達。但卻有證據表明HBsAg和HBeAg大量存在於外泌體中。有學者發現,HBV感染者外周血血清中分離出外泌體中包裹有大量的病毒成分,包括DNA、RNA、HBsAg和HBeAg。還有研究報導,HCV患者肝細胞中分離出的外泌體中存在完整的病毒RNA、蛋白和病毒顆粒。外泌體可能是病毒轉移感染下一個細胞的重要途徑。
外泌體是肝炎病毒的重要傳播介質
人們首先發現,外泌體可以介導HCV的感染。Ramakrishnaiah等研究表明,HCV感染者的外泌體可體外引起肝細胞系Huh7.5.1細胞發生HCV感染,即檢出HCV RNA;而且,外泌體可以保護其中的HCV免受IgG中和作用,發生免疫逃逸。又有學者發現,外泌體中HCV RNA與Ago2-miR122-HSP90形成了複合體,增強了HCV RNA的穩定性,提高了複製能力。而且,外泌體還能將HCV傳遞給樹突細胞(dendritic cell,DC),刺激Ⅰ型IFN的產生。繼而Yang等觀察到,攜帶有HBV DNA和蛋白質的外泌體,經熒光色素DiD標記並感染NK細胞後,可在NK細胞中檢出相應的外泌體並檢出HBV DNA,包括鬆弛環狀的雙鏈DNA(relaxed circular DNA,rcDNA)和共價閉合環狀DNA(covalently closed circular DNA,cccDNA);通過透射電鏡可見NK細胞中的病毒顆粒;進入NK細胞的HBV可經視黃酸(維甲酸)誘導基因蛋白I(retinoic acid-inducible gene I,RIG-1)依賴的方式抑製核因子κB(nuclear factor κB,NF-κB)和p38的活性而影響NK細胞的功能。而且,應該注意到,病毒RNA可通過RIG-1樣受體(RIG-I-like receptors,RLRs)途徑激活天然免疫系統。這給外泌體介導的病毒感染的作用賦予了更加重要的意義。
單核細胞感染是HBV疫苗逃逸的重要策略之一,也是肝移植後HBV感染複發的重要原因,同時也是耐葯作用產生的重要機制。目前對於該感染過程的唯一解釋是pre-S1受體也存在於單核細胞膜表面。但這一結論並不十分可靠,因為Pontisso的研究只是發現抗pre-S1抗體可抑製病毒顆粒黏附在單核細胞上,抗pre-S2和抗HbsAb則不能,並沒有真正觀察到黏附過程。而外泌體介導的感染過程與之不同,可能根本不需要這些受體。這極大地豐富了HBV感染單核細胞的分子機制,同時也為疫苗逃逸給出了新的解釋。但其中的轉染機制尚有待進一步研究。
外泌體對於內容物的保護作用是顯而易見的。雖然尚無證據表明抗病毒藥物無法殺滅外泌體中的病毒,但是至少可見IgG無法中和其中的病毒成分。另外,外泌體中攜帶的一系列miRNA可發揮抑製免疫反應、促進慢性感染的作用。面對來自外泌體對治療挑戰,Li等用IFN-α處理肝非實質細胞( liver nonparenchymal cells,LNPCs)後,分離其外泌體,然後作用於HBV感染的肝細胞,即將LNPCs中的抗病毒活性通過外泌體轉移肝細胞,從而實現HBV感染細胞抗病毒功能的逆轉,這是一次非常有意義的探索。
血清外泌體中肝炎標誌物對檢測的影響
在羅氏最新的Cobas MPX方法檢測HBV、HCV的研究中,研究者發現了17名健康人HbsAg陰性,而MPX檢測HBV DNA陽性的情況。這樣的隱匿性感染情況曾經多被解釋為HbsAg突變,或檢測敏感性低。但外泌體為這一矛盾提供了新的解釋。因為核酸檢測方法有裂解細胞膜和其他膜結構的環節,理論上也會破壞外泌體膜,從而可檢測到外泌體中的DNA或RNA;而ELISA方法檢測血清中的可溶性標誌物如HbsAg和HbeAg則不含有類似的操作,因此存在外泌體中的HbsAg和HbeAg無法被檢測到的可能。尤其令人擔憂的是,如果外泌體是HbsAg和HbeAg的主要發源地,那麼其對檢測結果的臨床意義的影響將大大增加。
在本實驗室進行的初步調查中,我們分別檢測了血清和血清分離的外泌體中的HBV DNA。在血清HBV DNA在107範圍內,兩個檢測結果相當,比值在0.15~1.6之間;在血清HBV DNA在107以上的8份標本中,外泌體HBV DNA含量則明顯高於血清值,最高可達9.8倍。這一結果一方面提示,外泌體是HBV DNA的重要來源;另一方面,核酸檢測對於臨床治療效果的判斷不會由於其存在於外泌體而產生明顯差異。但是,在對兩種樣本HbsAg的檢測中可見,血清外泌體中含有大量的HBsAg,其相對含量高於血清:HbeAg在43份標本中19份外泌體高於血清,24份血清高於外泌體,最高差距210倍。外泌體中的HbsAg和HbeAg對感染情況的判讀產生了重要影響。鑒於此,我們至少相信,DNA和RNA的檢測結果的金標準的意義將由於不受外泌體的影響而進一步增強;隱匿性感染的又一個原因是病毒標誌物存在於外泌體。對此,需展開更深入的研究,分析外泌體在HBV和HCV的核酸和抗原釋放機制,探討外泌體的存在對這些標誌物檢測結果和臨床意義的切實影響。