韓超 譯, 竇曉光 審校
中國醫科大學附屬盛京醫院


慢性HCV感染是慢性肝病的主要原因,全球患病率為1%~2%。HCV感染與肝損傷及其相關肝外併發症導致的發病率和病死率增加相關。其中,腎臟受累最為常見,包括蛋白尿、不同類型的腎小球腎炎、冷球蛋白血症(MC)和慢性腎臟病(CKD)。目前普遍認為HCV感染易發生CKD,且能夠增加非透析CKD患者終末期腎病(ESRD)風險和病死率、血液透析患者病死率以及腎移植受者的移植腎損傷,進而導致腎病患者的預後進一步惡化。
直接抗病毒藥物(DAA)治療可以獲得較既往聯合或不聯合利巴韋林的干擾素治療方案更高的持續病毒學應答率。從腎臟的角度來看,DAA具有雙重優勢:改善既定CKD患者的預後,並可以有效預防新發CKD。
對合併HCV感染的CKD患者的管理需要多學科協作,因此義大利肝病學會、義大利傳染病和熱帶病學會、義大利內科學會和義大利腎臟病學會成立聯合委員會編寫本專家共識。該文件並非正式指南,旨在作為製訂合併HCV感染的腎病患者治療決策的參考,指導相關臨床管理。
1 CKD的流行病學:分期和流行
聲明 :腎臟病的病因、預估腎小球濾過率(eGFR)和蛋白尿是用於CKD分期的3個指標。根據GFR和蛋白尿持續>3個月的改變,一般人群和HCV感染患者可以採用相同的CKD分期。
CKD分期基於3個指標:腎臟病的病因(腎小球、血管、腎小管間質、囊性或先天性)、腎功能異常和腎損傷的存在。腎功能異常(通過eGFR評估)和(或)腎損傷(通過蛋白尿、尿沉渣異常、腎活組織檢查證實腎組織學改變、腎臟影像學檢查證實腎臟結構損傷和腎移植史等)必須持續至少3~6個月才能定義CKD。根據eGFR將腎功能分為6期,根據蛋白尿分為正常(A1)、中度(A2)和重度(A3)。蛋白尿是腎損傷最重要的標誌物,也是CKD進展最有力的危險因素,可以通過24 h尿或晨尿中Alb/肌酐(Cr)比率(ACR)進行評估。
聲明:義大利普通人群中CKD的患病率約為7%。
據統計,義大利共有2 180 542例成年(年齡35~79歲)CKD患者(49.3%為男性),其中大多數處於疾病早期(60.4%),且年齡較大(69.8%)。
聲明:CKD人群的病死率、心血管疾病風險、進展至晚期CKD風險和住院治療風險均增加。
由於代謝和激素功能障礙以及水電解質異常,CKD人群面臨高發病率和病死率的風險。CKD相關併發症(如高血壓、貧血、繼發性甲狀旁腺功能亢進、氧化應激和營養不良等)增加其腎臟病和心血管疾病風險。CKD與住院風險之間存在密切關聯,其中心臟病、高血壓和感染是患者住院治療的最常見原因,而CKD進展和急性腎衰竭是最常見的繼發原因。
聲明:HCV感染患者更易發生急性腎損傷(AKI)。
AKI的嚴重程度可以根據肌酐(Cr)水準和尿量分為3個等級。AKI 1級:Cr水準較基線值升高50%~100%,或者與少尿相關的Cr絕對值增加≥0.3 mg/dl(利尿後12 h尿量<0.5 L);AKI 2級:Cr較基線水準升高2~3倍,少尿持續>12 h;AKI 3級:Cr較基線水準升高3倍,或≥4.0 mg/dl,或開始腎臟替代治療和無尿超過12 h。AKI的風險不僅隨著eGFR下降而逐漸增加,也隨著蛋白尿的增多而增加。
HCV感染患者更易發生以腎功能受累或急性腎小管壞死為主的AKI。發生AKI的患者不僅更易發展為CKD或接受透析,且死亡風險增加了2倍,可能是由於AKI發作引起腎纖維化或腎小管間質損傷持續存在,進而促進腎損傷的慢性化。
聲明:將CKD患者轉診至腎病科的時機應基於eGFR、蛋白尿和併發症情況。
當患者eGFR<30 ml-1·min-1·1.73 m-2或嚴重蛋白尿(A3類)時,推薦轉診至腎病科。存在以下CKD併發症應早期轉診:快速eGFR下降(>5 ml-1·min-1·年-1或GFR分期無變化,但至少降低25%)、血尿、頑固性高血壓(應用包括利尿劑在內≥3種藥物,但血壓仍高於目標值)、嚴重貧血(Hb< 11 g/dl)、電解質紊亂、高磷血症、繼發性甲狀旁腺功能亢進和遺傳性腎病。
2 HCV感染和腎小球損傷:病原學-實驗室檢查和組織病理學方面
聲明:應對所有腎小球疾病患者(尤其是冷球蛋白性腎炎患者)行HCV感染篩查。
HCV感染與大範圍腎小球疾病及其臨床後遺症有關。最常見的是繼發於Ⅱ型混合型MC的冷球蛋白性腎小球腎炎(冷球蛋白性腎病),其組織學特徵為Ⅰ型膜增生性腎小球腎炎(MPGN)。
聲明:致病機制可能與病毒感染間接或直接相關,應考慮到引起病毒迅速複製,進而增加病毒血症的措施帶來的風險。
HCV相關性腎病的發病機制尚未完全闡明,可能與腎臟感染直接相關或由宿主的免疫反應介導。腎損傷的直接機制可能是由於細胞的活動性感染和(或)僅通過病毒與細胞表面受體的附著,引起直接的細胞病變效應,導致內皮細胞、系膜細胞炎症和足細胞損傷。腎損傷的間接機制主要是繼發於宿主免疫反應,表現為循環免疫複合物的產生和沉積的影響。
聲明:檢測血清冷球蛋白、補體和類風濕因子(RF)水準有利於正確的診斷,即使在沒有MC性血管炎癥狀的患者中也是如此。
在冷球蛋白性腎病中,腎活組織檢查通常顯示Ⅰ型MPGN的特徵,並且其主要與Ⅱ型MC相關。冷球蛋白腎病的特徵在於腎小球基底膜(GBM)的複製,系膜細胞(特別是單核細胞)插入GBM,白細胞滲出伴系膜增生,腔內透明假血栓(對應於冷球蛋白沉澱)和罕見的毛細血管外增殖。
聲明:HCV陽性患者腎移植後,最常見的HCV相關性腎病是MPGN [通常與MC、低補體血症和(或)RF相關]。
HCV相關性腎小球病是腎移植後最常報告的HCV相關不良事件之一,而MPGN被認為是最常見的腎小球病(5%~54%)。HCV感染患者腎移植後發生的腎臟疾病還包括膜性腎病、微小病變、腎血栓性微血管病、局灶性節段性腎小球硬化、急性和移植性腎小球病。
3 HCV感染和腎臟風險:慢性腎病的獲得和進展
聲明:所有診斷CKD的患者均應接受HCV感染篩查。
CKD患者(特別是接受常規血液透析的患者)的丙型肝炎患病率和發病率高於腎功能正常患者。一些觀察性研究表明,HCV促進一般人群中CKD的發生或發展。因此,無論是否存在腎病的常規危險因素,HCV感染患者應被視為CKD的高風險人群。
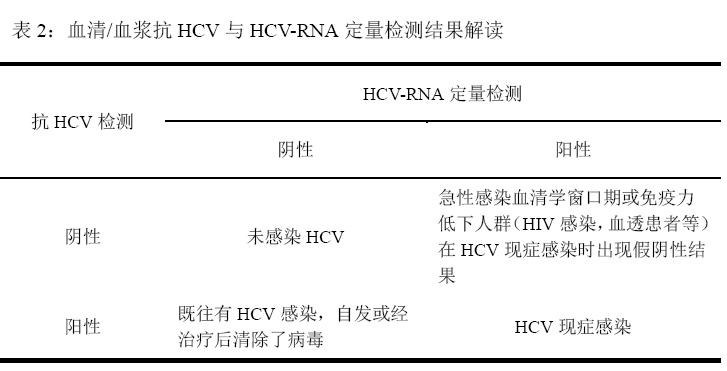
聲明:應用酶免疫測定法行HCV感染篩查,並行核酸檢測。非透析CKD患者應在門診轉診時進行篩查。
通過第4代酶免疫測定檢測抗-HCV是最常用的HCV感染篩查方法,較其他檢測能夠更早地檢測出抗-HCV。部分透析患者可能檢測出抗-HCV陰性,但檢測血清中病毒顆粒(HCV RNA)持續陽性。改善全球腎臟病預後組織(Kidney Disease: Improving Global Outcomes,KDIGO)HCV工作組建議所有CKD患者檢測HCV。本共識建議在血液透析患者中通過免疫測定進行初步檢測,如果陽性,必須行核酸檢測。
聲明:所有診斷HCV感染的患者均應檢測尿液和eGFR篩查腎臟疾病。如果CKD初篩為陰性,則可檢測到HCV RNA的HCV感染患者應定期(2次/年)篩查CKD。
CKD和HCV感染以不同的方式相互關聯。HCV感染和CKD在發達國家的普通人群中普遍存在,常規血液透析的患者具有感染HCV的風險,並且HCV感染可引起某些類型的腎病。
部分隊列研究證實,抗-HCV血清學陽性與CKD進展之間存在顯著相關性,抗-HCV血清學陽性與HIV感染患者中低eGFR風險增加相關。在接受抗HCV治療的HCV肝移植受者中,持續病毒學應答可使HCV感染的肝移植患者的輕度CKD在移植前發生eGFR改善。一項台灣的研究顯示,抗病毒治療與ESRD風險降低相關。
聲明:合併HCV感染的CKD患者應隨時間連續監測eGFR和蛋白尿,以評估CKD的進展。
除了冷球蛋白性MPGN之外,HCV感染者可能存在與失代償性肝硬化、應用注射藥物以及伴隨HIV或HBV共感染相關的腎損傷風險。最近的證據表明,HCV促進包括腎在內的各種組織和器官中動脈粥樣硬化的發展。這些發現均支持密切監測腎損傷(主要通過eGFR和蛋白尿)隨時間的變化,以便發現早期和快速進展的腎病患者。
4 慢性腎病患者的肝病分期
聲明:只有在臨床需要時才應考慮行肝活組織檢查。在特定情況下應考慮經頸靜脈入路(代替經皮經胸途徑)。
雖然肝活組織檢查在診斷肝纖維化方面廣泛開展並且公認,但肝活組織檢查是一種具有相關併發症的侵入性技術。最常見檢查類型是經皮肝活組織檢查,然而經靜脈肝活組織檢查(經頸靜脈或經股動脈途徑)是一種替代技術,通常在存在腹水、嚴重凝血功能障礙或PLT減少禁忌經皮穿刺的情況下使用。當需要額外的診斷數據(即門靜脈高壓症的診斷)時,也採用經頸靜脈肝活組織檢查。CKD患者,特別是ESRD患者,經常出現明顯的凝血障礙和出血性併發症,給接受侵入性手術的患者帶來額外風險。由於與尿毒症相關的PLT功能障礙,即使INR和PLT水準正常,經皮肝活組織檢查也不完全安全。
聲明:瞬時彈性成像、APRI評分和FIB-4評分作為非侵入性纖維化分期評估已經在ESRD的患者中得到驗證。在腎病患者中,FibroTest不是纖維化分期的準確預測因子。
通過簡單和廣泛可用的血液檢查(如APRI或FIB-4評分)能夠可靠的預測在ESRD中HCV感染者的肝纖維化分期。瞬時彈性成像在評估肝纖維化的嚴重程度方面優於APRI,並且可以顯著降低合併慢性丙型肝炎的血液透析患者行肝活組織檢查的必要。FibroTest和Actitest似乎不是合併HCV感染的血液透析患者可靠的非侵入性標記物。
聲明:肝彈性硬度>9.2 KPa和(或)APRI>0.8和(或)FIB-4>3.25的患者每半年應進行1次HCC超聲篩查和肝功能監測。對於門靜脈高壓唯一癥狀為腹水的晚期腎病患者,應通過測量肝靜脈壓梯度來評估其肝病預後。
在橫斷面研究中,肝硬度值、APRI評分和FIB-4評分在ESRD患者中診斷肝硬化的最佳臨界值分別為9.2 kPa、0.8和3.25。因此,對於瞬時彈性成像和(或)APRI或FIB-4評分等於或低於最佳臨界值的患者,必須行HCC和肝功能失代償的篩查。ESRD患者的腹水發生可能與肝外原因有關,在晚期腎病患者罹患肝病的早期階段即可能發生,因此,對於肝功能失代償唯一標誌為腹水的患者,應通過肝靜脈壓梯度評估更好地評估預後。
5 避免HCV在血液透析中心的傳播
聲明:感染控制操作應包括標準預防措施和其他患者護理步驟,以防止血液(或被血液汙染的液體)直接或通過受汙染的設備或表面在患者間傳播。透析中心的感染控制操作應按照一定的標準進行定期審查。
維持性透析患者的HCV感染率仍高於普通人群。醫院傳播是目前血液透析患者產生HCV抗體最有可能的來源。同一透析單元內治療的患者之間的HCV傳播,往往是因為該單元未遵循感染控制流程造成設備和其他物品(包括手套)的交叉汙染,而通過透析機的內部途徑傳播僅在一小部分情況下出現。其他可能的傳播途徑來自於患者之間的直接接觸、接受了已感染的供血者的血液、在透析中心外使用了被傳染源或新發感染者汙染過的器械進行侵入性操作以及來自於發展中國家假日期間的透析。
所有醫院都應採取標準預防措施,包括在需要時使用手套、罩衣或口罩,以減少血液傳播和其他病原體從公認和未被確認的來源傳播的風險。
聲明:不推薦對HCV感染的血液透析患者進行隔離。
由於缺乏可靠的隨機對照試驗,隔離對於控制血液透析中心HCV擴散的益處和隔離手段尚不清楚。不建議隔離感染HCV的透析患者以防止HCV在透析單元內的傳播。然而,在透析室,如果加強和審核旨在防止血液傳播病原體(包括HCV)的感染控制操作後仍有HCV院內傳播時,應考慮對感染HCV的透析患者實行本地隔離措施。在任何情況下,隔離不建議作為實施和遵守透析單元感染控制的替代方法。
聲明:不推薦對HCV感染的血液透析患者使用專用透析機。
關於抗HCV陽性患者在血液透析或腹膜透析過程中汙染超濾液或透析液的數據存在爭議。大部分報告排除了透析機內部汙染引起HCV傳播的可能性,而血液透析機的外部汙染被認為是血液透析過程中HCV傳播的一種重要方式,在許多暴發報告中,經常發現機器外部和其他表面消毒不徹底。
聲明:慢性血液透析患者應在首次進入或再次轉入透析中心時接受抗-HCV篩查。易感血液透析患者應每年檢測2次抗-HCV。在出現肝病的體征或癥狀(如肝酶升高)和(或)在同一透析中心發生新發HCV感染的情況下,應進行篩查。
本共識建議每年2次對未感染HCV(抗-HCV陰性)的血液透析患者進行重複篩查,以發現新的HCV感染。有危險性行為的血液透析患者應更頻繁地進行篩查。此外,抗-HCV陽性/HCV RNA陰性患者(已治癒的HCV感染患者)需要定期篩查(2次/年),一旦暴露仍有再次感染的風險。新發感染可能代表透析中心內HCV的傳播。當血液透析單元發現新的HCV感染時,透析單元內所有核酸檢測(nucleic acid testing,NAT)陰性患者都應接受HCV感染檢測,並增加隨後的HCV檢測頻率。HCV檢測應採用NAT。CDC建議對所有維持性血液透析患者在入院時行ALT水準篩查,並對易感患者每月進行1次ALT檢測。由於維持性透析患者的HCV感染過程無癥狀,因此應經常通過ALT水準來確定獲得性感染患者可能的暴露時間。
6 CKD患者中HCV感染的治療
聲明:聯合應用不同種類的、作用於HCV複製周期不同位點的DAA,以獲得持續病毒學應答。
HCV的治療基於DAA,即針對病毒複製周期的藥物。這些藥物主要針對HCV複製的關鍵步驟:NS3蛋白酶催化的多蛋白分裂(蛋白酶抑製劑),HCV RNA鏈的合成(NS5B聚合酶抑製劑,包括核苷類似物和非核苷類似物)以及複製複合物的穩定和病毒釋放(NS5A抑製劑)。
聲明:CKD的存在影響DAA的葯代動力學。
索磷布韋(sofosbuvir):大約80%的索磷布韋從腎臟排出,15%從糞便中排出。目前,對於嚴重腎損傷(eGFR<30 ml-1·min-1·1.73 m-2)或ESRD患者(gs-331007的積蓄量高達20倍),不推薦任何劑量的應用。
維帕他韋(velpatasvir):維帕他韋原型藥物經膽汁排泄是其消除的主要途徑。相對於腎功能正常的患者,對於HCV陰性合併嚴重腎損傷患者(eGFR<30 ml-1·min-1·1.73 m-2),維帕他韋受試者工作特性曲線下面積升高50%,但被認為無臨床相關意義。
利托那韋(ritonavir)/帕立瑞韋(paritaprevir)/奧比他韋(ombitasvir)±達塞布韋(dasabuvir):帕立瑞韋、奧比他韋主要經糞便排出。達塞布韋在肝臟中代謝,其主要代謝物主要通過膽汁排泄和排便清除,腎清除最少。嚴重腎損傷患者(Cr清除率為15~29 ml/min),帕立瑞韋的受試者工作特性曲線下面積升高45%,利托那韋升高114%,達塞布韋升高50%。目前,輕、中、重度腎損傷患者無需調整劑量。
格拉瑞韋(grazoprevir)/艾爾巴韋(elbasvir):格拉瑞韋和艾爾巴韋排除的主要途徑是膽汁和糞便,尿中回收率少於1%。輕度、中度及重度腎損傷患者(包括血液透析或腹膜透析患者)無需調整劑量。
格卡瑞韋(glecaprevir)/呱侖他韋(pibrentasvir):在進行透析或不透析的HCV感染者中,格卡瑞韋/呱侖他韋暴露量的變化無顯著臨床意義。對於有任何程度腎損傷的患者,包括透析患者,無需調整格卡瑞韋/呱侖他韋的劑量。
聲明:對於CKD 4~5期或進行血液透析的HCV患者,應儘可能採用無索磷布韋的方案。
對於腎功能嚴重下降的CKD 4期患者(eGFR 15~29 ml-1·min-1·1.73 m-2)和CKD 5期患者(eGFR<15 ml-1·min-1·1.73 m-2或透析組),尚缺乏以索磷布韋為基礎的方案的臨床試驗,尚未確定晚期腎病或ESRD患者應用索磷布韋的治療劑量。因此,CKD 4~5期的丙型肝炎患者應該選擇無索磷布韋的方案。CKD患者在應用帕立瑞韋/奧比他韋/達塞布韋、格拉瑞韋/艾爾巴韋或格卡瑞韋/呱侖他韋時不需要劑量調整。
聲明:在合併CDK的HCV感染者中,一般不推薦應用利巴韋林。
由於腎損傷患者血液中利巴韋林的累積,導致貧血和治療相關副作用的發生率增加,因此宜採用無利巴韋林治療方案。此外,血液透析清除利巴韋林的效果較差。如果必須應用利巴韋林,則建議在血液透析後,按照200 mg/次,1次/d或1次/2 d或3次/周,並應該促進患者的造血功能。
聲明:在某些情況下,以索磷布韋為基礎的方案和利巴韋林是可以考慮的,但必須仔細權衡利弊。
如果治療很緊急,且沒有無索磷布韋的方案可供選擇,則應仔細權衡以索磷布韋為基礎的方案的風險和收益。同時需要密切監測,如果腎損傷惡化,如腎功能突然受損或蛋白尿出現/加重,治療應立即中斷。
7 HCV與腎移植
聲明:腎移植受者HCV感染率較高。腎移植是合併HCV感染的ESRD患者較好的治療方法。HCV感染的腎移植受者的臨床結局較未感染者差。
腎移植受者HCV感染率很高,其HCV陽性率預計達6.8%。腎移植是合併HCV感染的ESRD患者較好的治療方法。一項Meta分析顯示,與等待移植的患者相比,接受腎移植的HCV感染患者的存活率更高。一般HCV患者的移植後結局較未感染的腎移植受者差,主要原因是心血管疾病發病率升高、移植後糖尿病和傳染病的發病率增加,以及肝臟疾病的進展,包括肝硬化和肝細胞癌。
聲明:DAA治療對感染HCV的腎移植受者安全有效。治療方案和療程應根據現有指南,結合肝纖維化分期、HCV基因型、腎功能和藥物相互作用而製訂。
新的DAA療法在腎移植受者中有效且安全,90%~100%的病例獲得了持續病毒學應答,嚴重不良事件的發生率較低,移植後治療期間腎功能也保持穩定。
聲明:DAA治療(包括腎移植前後的時機選擇)應該具有個體化,既兼顧個人的臨床情況又要縮短等待時間。腎移植後延遲治療的決定必須考慮到正在實施的國家HCV陽性器官分配計劃。
治療腎移植受者的最佳時機(移植前或腎移植成功後)仍是一個尚未解決的問題。總的來說,ESRD患者在腎移植前治療HCV似乎是一個很好的時機,這樣可能避開DAA對移植後免疫抑製劑的干擾。
然而,這一策略不適用於接受HCV陽性的腎臟供體的腎透析患者。實際上,等待腎移植的HCV陽性、未接受抗病毒治療的患者可以選擇等待HCV陽性的腎源。這項政策的益處在於競爭HCV陽性腎源的患者相對較少,進而減少等待時間。然而,HCV陽性器官的高不可用率將削弱這一方案的實際應用。此外,儘管HCV陽性腎病患者接受HCV陽性腎源的方案具有諸多益處,但仍需考慮以下幾點問題:病毒幾乎全部直接傳播、不同基因型重疊感染的可能,以及與接受正常腎源的患者相比,接受HCV陽性腎源患者自身和移植物存活情況。可參考義大利國家器官移植中心發布的義大利HCV陽性器官移植指南。
聲明:腎移植受者接受DAA治療必須在腎臟病醫生和肝臟病醫生的密切合作下進行。仔細評估腎功能、肝纖維化分期、HCV基因型、免疫抑製方案和共同治療可以安全地解決抗病毒藥物的選擇問題。
DAA和免疫抑製劑同時應用可產生藥物-藥物相互作用(DDI),應正確選擇治療方案,在治療過程中監測其療效,並在適當情況下進行治療藥物監測,從而積極預防DDI。
對於腎移植受者中HIV/HCV共感染的特殊人群, DDI的監測必須包括抗逆轉錄病毒藥物,並通過腎病科醫師、肝病科醫師和HIV方面專家以多學科方式指導DAA方案和(或)抗逆轉錄病毒藥物的應用。因此,本聲明強烈推薦參考www.hep-druginteractions.org和www.hiv-druginteractions.org的藥物相互作用圖表。
8 小結
不同學科醫療專業人員需密切合作,以求及時診斷,並根據患者的臨床情況製訂最合適的治療方案。
腎病科醫師必須對所有首診的患者篩查抗-HCV。在抗-HCV陽性情況下,必須完善病毒載量檢測,如有可能應行HCV基因型檢測。一旦腎病科醫師完成CKD分期,患者必須轉診至肝病科,進行肝病學分期,並評估是否接受DAA治療。DAA的選擇由肝病科醫師負責,但建議與腎病科醫師討論協同治療方案,處理腎臟相關情況以及合併症,以便選擇最合適的DAA方案。對DAA反應的監測仍應由肝病科醫師專門負責,同時要求其監測的實驗室檢查指標至少包括血清Cr和蛋白尿(通過晨尿ACR或收集24 h尿液測定)。當出現AKI[血清Cr水準升高>0.3 mg/dl和(或)蛋白尿的出現或惡化]時,肝病科醫師必須將患者轉診至腎病科,以明確診斷並實施專業治療。
引證本文:韓超, 竇曉光. 《2018年義大利肝病學會/義大利內科學會/義大利傳染病和熱帶病學會/義大利腎臟病學會專家共識:慢性腎臟病患者HCV感染的管理》摘譯[J]. 臨床肝膽病雜誌, 2019, 35(4): 762-765.
TAG: |