撰文 | 秋楓
責編 | 兮
近些年來,研究人員發現,一些受體酪氨酸激酶 (receptor tyrosine kinase, RTK) 能夠出現在細胞核內,可能參與某些基因表達調控,但是具體的分子機制,還未研究清楚【1】。作為一種受體酪氨酸激酶,胰島素受體 (Insulin receptor, IR) 同樣被發現存在於細胞核內,但它在細胞核內的功能同樣沒有研究清楚。
胰島素受體的經典信號通路起始於其與胰島素的結合,之後,胰島素受體自磷酸化,然後激活一系列激酶,包括PI3K-AKT信號通路。而PI3K-AKT信號通路則通過對多個下遊靶蛋白的激活,調控了葡萄糖轉運、甘糖合成以及蛋白質翻譯等細胞生理活動【2】。這個信號通路的激活是一個快速的反應,AKT也能通過磷酸化轉錄因子FOXO1調控一些基因的表達,從而實現一些長期的 (long-term) 細胞生理活性調控,比如對糖代謝的調控就是通過轉錄因子FOXO1來實現的【3】。然而,胰島素受體對機體的長期調控並不僅限於目前的研究,其他更主要的模式機制還未研究清楚。
來自哈佛醫學院的John G. Flanagan教授團隊於2019年4月4日在 Cell 期刊在線發表了題為Insulin Receptor Associates with Promoters Genome-wide and Regulates Gene Expression的研究論文。他們發現,胰島素受體能夠在細胞核內結合到許多基因的啟動子區,調控這些基因的表達。胰島素受體調控的靶基因,大多數都與胰島素相關的一些功能有關。胰島素受體對這些基因的調控,受到胰島素與其受體結合的影響。


本研究首先利用免疫共沉澱 (immunoprecipitation) 和質譜 (mass spectrometry) 技術鑒定與胰島素受體存在相互作用的蛋白,結果顯示RNA聚合酶Ⅱ (RNA polymerase Ⅱ, Pol Ⅱ) 與胰島素受體之間存在相互作用。另外,胰島素受體的入核是通過分子伴侶蛋白HSP70來實現的,這與EGFR蛋白的入核機制非常相似。
接下來,通過CHIP-seq實驗發現,胰島素受體在細胞核內主要定位於轉錄起始位點 (transcription start site, TSS) 附近,與胰島素受體結合的基因位點主要與基因的轉錄激活相關,比如H3K4me3和H3K27ac位置附近,說明胰島素受體對基因的調控可能是通過激活基因的表達來實現的,而不是通過對基因表達的抑製作用。進一步的分析發現,胰島素受體的靶基因主要涉及到胰島素調控的一些生理功能,比如脂肪的合成和儲存、蛋白質合成、免疫以及轉錄等,而涉及到的疾病也是與胰島素相關,包括糖尿病、癌症和神經退行性疾病等,如圖1所示。

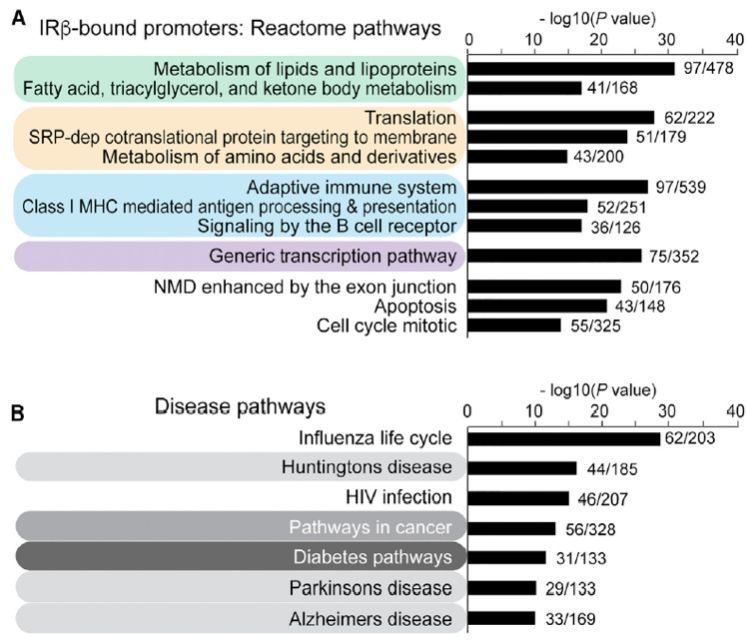
圖1 胰島素受體調控的基因
緊接著,研究人員測試了胰島素對於胰島素受體在細胞核內作用的影響,發現胰島素能夠促進胰島素受體與基因組的結合,促進RNA聚合酶Ⅱ的招募,並促進相關基因的表達。另外,胰島素受體對基因的調控作用具有細胞特異性,在肝癌細胞系HepG2中,胰島素受體激活的基因主要與脂肪代謝相關,這是肝臟組織的功能特異性,而在神經細胞系SH-SY5Y中,胰島素受體激活的基因則與囊泡轉運和RNA剪切等神經組織特異性功能相關。
因為沒有找到與胰島素受體特異性結合的DNA序列,所以研究人員通過親和純化以及質譜等技術找到了胰島素受體的另外一個結合蛋白,HCF-1 (Host Cell Factor-1) ,它能促進胰島素受體與基因組啟動子區的結合,是胰島素受體調控基因轉錄的輔助蛋白。一些與HCF-1結合併功能相關的轉錄因子,如OGT、THAP11、YY1、GABPA和ZNF143等也被證實能夠結合到胰島素受體結合的基因啟動子區,而胰島素受體調控的基因功能也被證實需要HCF-1的作用。
本研究還發現一個有趣的現象,即胰島素受體激活的基因主要與脂代謝相關,相反,與糖代謝相關的一些基因並沒有被胰島素受體激活。

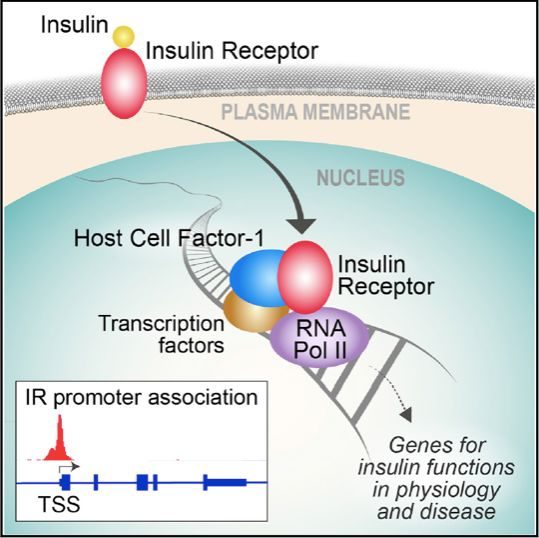
圖2 胰島素受體調控基因表達機制
總之,本研究發現,胰島素受體(IR)能夠與HCF-1等蛋白組成複合體,定位於細胞核內一些基因的啟動子區,激活這些基因的表達。胰島素受體對基因的這種調控方式,受到胰島素的影響,是胰島素調控細胞生理活動的一種長程反應方式。本研究對於理解糖尿病、癌症和神經退行性疾病等提供了一種新的思路,為治療這些代謝相關疾病發展了一種潛在的策略。
原文鏈接:
製版人:珂
參考文獻
1 Carpenter, G., and Liao, H.J. (2013). Receptor tyrosine kinases in the nucleus. Cold Spring Harb. Perspect. Biol. 5, a008979
2 Boucher, J., Kleinridders, A., and Kahn, C.R. (2014). Insulin receptor signaling in normal and insulin-resistant states. Cold Spring Harb. Perspect. Biol. 6. Published online January 1, 2014. https://doi.org/10.1101/cshperspect. a009191.
3 Kang, S., Tsai, L.T., and Rosen, E.D. (2016). Nuclear Mechanisms of Insulin Resistance. Trends Cell Biol. 26, 341–351
BioArt,一心關注生命科學,只為分享更多有種、有趣、有料的信息。關注投稿、合作、轉載授權事宜請聯繫微信ID:bioartbusiness 或郵箱:[email protected]。原創內容,未經授權,禁止轉載到其它平台。