撰文 | 阿童木
責編 | 兮
小腸上皮是形成小腸內膜的細胞層,由隱窩和絨毛兩部分組成,是哺乳動物體內更新速度最快、最具活力的組織之一【1】。由於其快速的自我更新能力和簡單的生理結構,目前已經成為哺乳動物成體乾細胞研究的模式系統【2】。
(leu-rich-repeat-containing G-proteincoupled receptor 5 隱窩基部柱狀細胞(crypt-base columnar cells, CBCs)驅動。CBCs在受到異塵餘生等損傷刺激後會發生丟失,此時另一類處於靜止狀態的『+4』位細胞,即 儲備乾細胞(reserve stem cells, RSCs)會激活並促進損傷小腸的再生 【3】。早期研究認為CBCs和RSCs是互斥的,後續研究發現LGR5+ CBCs會表達RSCs標記物,LGR5+細胞對於損傷小腸的修復是必需的,而RSCs在此過程中並非不可或缺 【4】。此外,吸收性腸細胞、分泌細胞和慢循環LGR5+細胞以及YAP1等轉錄因子均在小腸再生過程中發揮了重要作用。
2019年4月25日,加拿大西奈山醫院的Alex Gregorieff和Jeffrey L. Wrana領導的團隊在 Nature 上發文Single-cell transcriptomes of the regenerating intestine reveal a revival stem cell,發現了一類獨特的乾細胞,其會在小腸受損傷後激活以維持乾細胞池穩態並促進小腸上皮再生。


圖1 異塵餘生刺激會在小腸上皮誘導產生一類獨特的細胞類型
乾細胞動力學分析顯示,CBC信號位於富集的隱窩中,並被映射到第17簇(singly profiled stem cell cluster 1, SSC1);+4位和/或RSC標記物Bmi1和Hopx在多個簇中表達;而標記物Lrig1在少數分散細胞中表達量較高,在SSC1中表達水準較低。與這些單一標記物不同,第18簇(SSC2)幾乎完全由受異塵餘生的隱窩細胞組成,並能通過一些參與炎症反應、DNA損傷反應和細胞存活相關基因的表達來區分 (圖1b)。進一步分析SSC2的組成結構發現其包括3個不同的細胞群,即SSC2a、SSC2b和SSC2c (圖1c)。SSC2a具有明顯的SSC1特徵並與CBCs有關,SSC2b核糖體基因表達較高,SSC2c是一個靜止的細胞群,表達標記物Clu、Anxa1、Cxadr和Basp1等 (圖1d)。作者隨後構建了BAC-Clu-GFP轉基因小鼠以標記內源性Clu+細胞,結合免疫組化和流式細胞檢測,證明CLU+SSC2c細胞在正常生理狀態下數量稀少,是一種受腸道損傷誘導的獨特的靜止隱窩細胞,且具有YAP-1依賴性。在腸道乾細胞更新穩態維持過程中,CLU++CBCs和分化的子代細胞。異塵餘生刺激後,CLU+SSC2c能促進LGR5+作者構建了小腸上皮revSC缺陷型Cluless小鼠模型,異塵餘生處理後Cluless小腸上皮細胞增殖受阻,小腸隱窩數量和長度降低,結腸縮短,這與YAP1敲除導致的再生缺陷類似。右旋糖酐硫酸鈉(dextran sodium sulfate, DSS)處理會誘導小鼠腸道損傷,誘發小鼠產生腸炎,體重降低【5】。野生型小鼠DSS處理後,體重減輕等癥狀經治療可逐漸恢復,而Cluless小鼠體重會持續減輕並很快死亡。未經處理的Cluless小鼠小腸與野生型相似,而DSS處理會導致隱窩數量和長度降低,上皮層破壞,還會特異性導致小腸絨毛脫落。+revSCs的子代細胞是腸上皮再生的主要貢獻者。
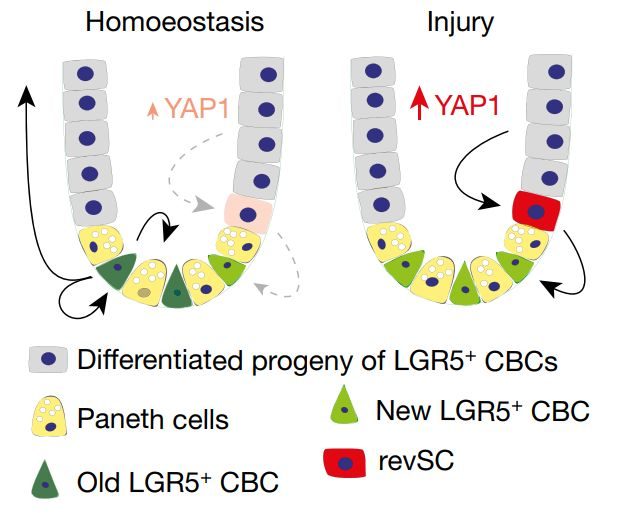
綜上所述,本研究發現了一類新的小腸乾細胞——revSCs,revSCs是一種緩慢循環的細胞類型,受YAP1信號調控後出現在受損的腸道中,以重建LGR5+CBCs乾細胞池,促進腸道再生。 因此,損傷引起的revSCs擴增可能是小腸損傷修復的關鍵機制。
原文鏈接:
製版人:珂
參考文獻
1. Barker, N., van de Wetering, M., & Clevers, H. (2008). The intestinal stem cell. Genes & development, 22(14), 1856-1864.
2. 亓振, & 陳曄光. (2014). 小腸乾細胞的命運調控. 中國科學: 生命科學, 44(10): 975–984.
3. Takeda, N., Jain, R., LeBoeuf, M. R., Wang, Q., Lu, M. M., & Epstein, J. A. (2011). Interconversion between intestinal stem cell populations in distinct niches. Science, 334(6061), 1420-1424.
4. Metcalfe, C., Kljavin, N. M., Ybarra, R., & de Sauvage, F. J. (2014). Lgr5+ stem cells are indispensable for radiation-induced intestinal regeneration. Cell stem cell, 14(2), 149-159.
5. Oh, S. Y., Cho, K. A., Kang, J. L., Kim, K. H., & Woo, S. Y. (2014). Comparison of experimental mouse models of inflammatory bowel disease. International journal of molecular medicine, 33(2), 333-340.
BioArt,一心關注生命科學,只為分享更多有種、有趣、有料的信息。關注投稿、合作、轉載授權事宜請聯繫微信ID:bioartbusiness 或郵箱:[email protected]。原創內容,未經授權,禁止轉載到其它平台。