尚佳 寧會彬
河南省人民醫院感染科
慢性HCV感染的DAA治療現狀HCV感染呈全球流行,全世界有1.3~1.7億人為慢性HCV感染,2%~5%死於肝硬化和肝細胞癌。中國為HCV感染人數最多的國家,推算有1000萬例HCV感染者,其中250萬例急需治療,因此,我國HCV感染的疾病負擔非常嚴重。
直接抗病毒藥物(DAA)的出現,極大地改善了HCV感染患者的治療狀況:與基於干擾素(IFN)的治療方案相比,療效顯著提高,患者可獲得95%以上的持續病毒學應答率(SVR);在安全性和耐受性方面,不良事件或終止治療的發生率顯著降低;療程明顯縮短,用藥負擔小,服用更方便,患者的依從性明顯提高;適用人群廣泛,包括IFN不適合或不耐受、之前治療無應答、肝硬化或老年慢性HCV感染患者,均可接受DAA方案治療。
慢性丙型肝炎的合併症顯著影響DAA臨床治療與臨床研究不同,現實世界中的DAA臨床治療面臨很多問題,治療前需要評估的因素包括:基因型及是否存在基線耐葯、血液系統相關指標、肝纖維化及肝功能狀態、腎功能狀態[估算的腎小球濾過率(eGFR)水準]、是否存在HBV或HIV共感染、是否存在合併用藥[藥物相互作用(DDI)的發生風險]等。
慢性丙型肝炎特殊患者人群包括肝硬化、經治失敗、肝移植、合併腫瘤、合併HIV或HBV感染、合併腎損害、高血壓、糖尿病、自身免疫性疾病或血液系統疾病患者以及兒童和妊娠期患者。慢性C肝的合併症給DAA臨床治療帶來顯著影響,增加了治療難度和不良反應的風險:合併用藥使發生DDI的風險增加,如終末期腎病等腎功能受損使藥物選擇受到限制[1, 2]。
HCV感染導致糖尿病和心血管疾病風險增加的機制:HCV直接干擾胰島素信號以及引起可溶性介質分泌,導致肝臟和肝外胰島素抵抗,從而增加2型糖尿病(T2DM)的發生風險;HCV通過導致全身慢性炎症、慢性內皮損傷以及直接影響血管壁動脈粥樣硬化,聯合上述T2DM發生機制,共同導致心腦血管事件的發生風險增加[3]。
日本一項回顧性觀察性隊列研究對173767例慢性HCV患者的合併症、合併用藥和DDI進行分析(圖 1),患者的平均年齡為67.36歲,其中63.8%為65歲以上,大多數患者的醫療記錄顯示具有合併症和服用多種藥物,至少1種以上處方的患者比例為73%;隨著年齡增長,更多患者出現至少1種合併症,18~34歲和75歲以上年齡組的併發症患病率分別為46.7%和86.9%。患者常見合併「三高」,DAA治療患者中,有33%合併高血壓,是最常見的合併症。
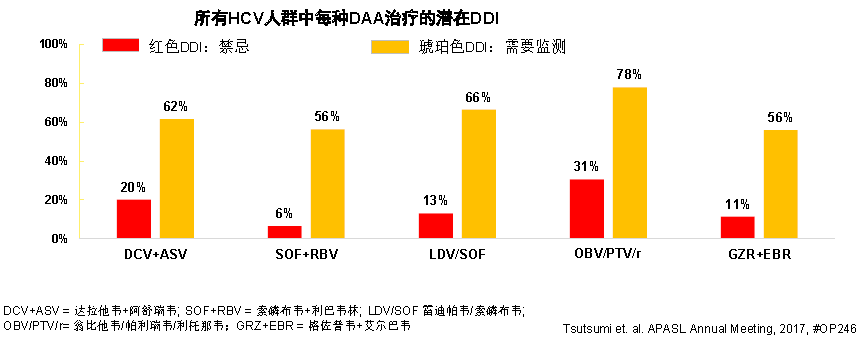
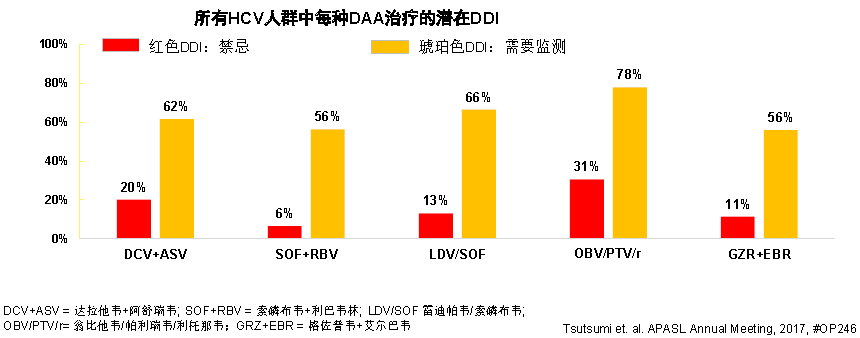
圖1 日本HCV感染患者的潛在DDI
我國台灣地區一項多中心前瞻性觀察性研究(882例)對HCV患者的合併症、聯合用藥和潛在DDI進行分析(圖 2),患者的平均年齡為62.7歲,其中49.4%為65歲以上,合併症患病率較高(86.3%患者≥1種合併症),廣泛使用合併用藥(75.9%患者≥1種合併用藥)。


圖2 台灣地區HCV感染患者的潛在DDI
因此,臨床實踐中,慢性HCV感染患者的合併症和多種藥物服用比率較高,選擇低DDI風險的DAA對病患比較有利。
慢性丙型肝炎合併高血壓美國一項回顧性隊列研究利用退伍軍人醫療系統的數據,納入2015年6月15日-2016年6月14日,由臨床醫師完成DAA事先授權藥物請求的患者,80.3%的患者至少發生一種DDI,平均每例患者發生DDI的數量為1.85(範圍:1-9),所有DDI中,76%為具有臨床意義或嚴重的藥物相互作用,心血管藥物為發生DDI的最常見門診聯合用藥(圖 3)。

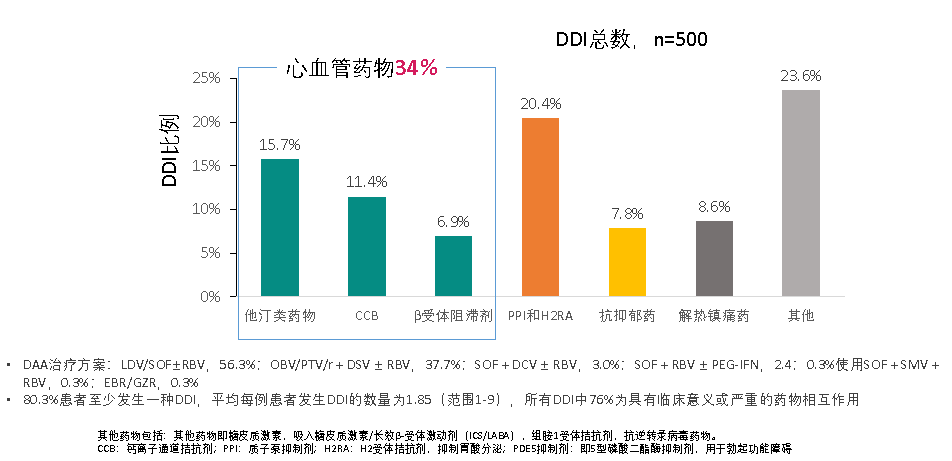
圖3 心血管葯成為發生DDI的最常見門診聯合用藥
DAA與合併用藥間的DDI可分為:①無臨床顯著相互作用;②潛在較弱的相互作用,不太可能需要進行劑量、給葯時間點調整或額外監測;③潛在相互作用,需要進行劑量、給葯時間點調整或額外監測;④不可聯合使用。常用心血管藥物、降脂或降糖藥物聯合DAA應用時的DDI風險如圖4和圖5。


圖4 常用心血管藥物聯合DAA使用的DDI風險


圖5 常用降脂、降糖藥物聯合DAA使用的DDI風險
選擇DAA方案時,需要考慮HCV基因型、患者年齡、Child-Pugh分級和慢性腎臟疾病(CKD)分級(eGFR)等因素[4],其中,eGFR≤30mL/min/1.73m2的腎功能不全患者應用索磷布韋(SOF)時,需要降低每日劑量至200 mg(表 1)。


常用降壓藥物代謝所需的酶類和轉運體特點不同,慢性HCV感染合併高血壓時用藥推薦流程見[4]。
慢性丙型肝炎合併糖尿病多項流行病學研究均表明,慢性HCV感染患者中的T2DM患病率顯著高於普通人群(圖 6)[5]。


圖 6 HCV感染患者2型糖尿病的發生率較普通人群增加
常用降糖藥物代謝所需的酶類和轉運體特點不同,慢性HCV感染合併T2DM時用藥推薦流程見圖 7[4]。


圖 7 基因1-6型HCV感染合併2型糖尿病時用藥推薦流程
美國一項觀察性研究[6]總共納入175例慢性HCV感染患者,其中31例(18.5%)患者合併糖尿病,應用DAA治療前後,患者的糖化血紅蛋白(HbA1c)水準無顯著性變化,胰島素應用率增加,差異無顯著意義。
埃及一項研究[7]納入460例基因4型(GT4)HCV感染合併T2DM的患者,包括400例接受DAA治療的患者和60例未接受DAA治療的對照組患者,將獲得SVR的378例患者進一步分組為292例(77.2%)患者血糖控制改善(IGC)和86例(22.8%)患者無IGC。在IGC組中,有78例(26.7%)患者需要減少降糖藥物應用,61例患者需要調整胰島素用量。應用DAA後IGC的相關因素包括T2DM病程、Child-Pugh分級和T2DM家族史。因此,合併T2DM的患者應用DAA治療期間,需監測血糖變化,及時調整降糖藥物應用,尤其是胰島素的用量,以免發生低血糖。
另外一項大型研究[8]納入2435例慢性HCV感染合併T2DM的患者,應用無干擾素DAA方案治療後獲得SVR患者的HbA1c下降水準顯著優於未獲得SVR者。進一步分析表明,獲得SVR與未獲得SVR者相比,無論是治療前HbA1c水準>7.2%,還是HbA1c水準≤7.2%的患者,均可使HbA1c水準顯著下降,無肝硬化患者的HbA1c水準顯著下降,而肝硬化患者的HbA1c水準並無顯著下降,患者獲得SVR後,降糖藥物尤其是胰島素的應用減少。
德國一項真實世界的研究[9]納入基因1型HCV感染患者,合併T2DM的患者比例約為10%,應用DAA的療效好,安全性高;德國另外一項真實世界的研究[10]表明,慢性HCV感染患者合併T2DM,對獲得SVR並無不利影響。
對於慢性HCV感染合併T2DM的患者,還要注意合併糖尿病腎病對DAA臨床治療的影響。2018年EASL丙型肝炎治療指南[11]建議,對HCV患者治療前的基線評估,應該確定腎功能(肌酐/eGFR)(A1);2017年KDIGO關於慢性腎臟疾病患者HCV預防、診斷、評估和治療臨床實踐指南[12]推薦所有患者在診斷HCV感染時,採用尿液分析和eGFR,篩查腎臟疾病(A1)。
對於GFR<30mL/min/1.73m2的重度腎損害且未接受血液透析的患者,應用阿舒瑞韋軟膠囊的推薦劑量為100 mg,每日一次;對SOF無相應推薦劑量;2016年7月5日,日本藥品和醫療器械管理局(PMDA)針對PRV/r/OBV提出需在說明書中增加腎臟安全性的警告:用藥前及使用後,進行常規腎功能監測,尤其注意對腎功能不全和合併使用鈣離子拮抗劑的患者進行監測,警惕出現腎功能急劇變差的可能性。
2018年EASL丙型肝炎治療指南[11]對慢性HCV感染合併腎損害患者的治療建議為:對於eGFR≥30mL/min/1.73m2的患者,治療方案參考一般人群;對於eGFR<30mL/min/1.73m2(CKD 4-5級)的患者,應該選擇格來普韋/匹布他韋(Glecaprevir/pibrentasvir, GLE/PIB)方案8周或12周療法(全基因型)、格拉瑞韋/艾爾巴韋(Grazoprevir/elbasvir,GZR/EBR)方案12周療法(基因1型和4型)或3D(帕利瑞韋/奧比他韋/利托那韋+達塞布韋,paritaprevir/ombitasvir/ritonavir + dasabuvir)方案12周療法(基因1b型),除非以上方案都不可及,需要謹慎使用SOF。
慢性C肝患者常見存在合併症及合併用藥,對於合併高血壓及糖尿病的患者,DAA的應用是安全有效的,但是,需要對DDI進行評估。在應用DAA治療的過程中,需要檢測血壓、血糖變化,及時調整藥物用量,以防止嚴重不良事件的發生。
參考文獻:(可上下滑動查看)
1.Hudson B, Walker AJ, Irving WL. Comorbidities and medications of patients with chronic hepatitis C under specialist care in the UK. J Med Virol. 2017; 89(12): 2158-2164.
2.趙西太, 聶青和. 直接抗病毒藥物治療丙型肝炎的毒副作用、藥物相互作用及安全性. 臨床肝膽病雜誌. 2017; 33(6): 1067-1073.
3.Negro F. Facts and fictions of HCV and comorbidities: steatosis, diabetes mellitus, and cardiovascular diseases. J Hepatol. 2014; 61(1 Suppl): S69-78.
4.王琴, 饒慧瑛, 魏來. 基於真實世界丙型肝炎合併疾病的潛在藥物相互作用及用藥推薦. 中華肝臟病雜誌. 2018; 26(3): 209-223.
5.Antonelli A, Ferrari SM, Giuggioli D, et al. Hepatitis C virus infection and type 1 and type 2 diabetes mellitus. World J Diabetes. 2014; 5(5): 586-600.
6.Stine JG, Wynter JA, Niccum B, et al. Effect of Treatment with Direct Acting Antiviral on Glycemic Control in Patients with Diabetes Mellitus and Chronic Hepatitis C. Ann Hepatol. 2017; 16(2): 215-220.
7.Dawood AA, Nooh MZ, Elgamal AA. Factors Associated with Improved Glycemic Control by Direct-Acting Antiviral Agent Treatment in Egyptian Type 2 Diabetes Mellitus Patients with Chronic Hepatitis C Genotype 4. Diabetes Metab J. 2017; 41(4): 316-321.
8.Hum J, Jou JH, Green PK, et al. Improvement in Glycemic Control of Type 2 Diabetes After Successful Treatment of Hepatitis C Virus. Diabetes Care. 2017; 40(9): 1173-1180.
9.H?ner Zu Siederdissen C, Buggisch P, B?ker K, et al. Treatment of hepatitis C genotype 1 infection in Germany: effectiveness and safety of antiviral treatment in a real-world setting. United European Gastroenterol J. 2018; 6(2): 213-224.
10.Welzel TM, Hinrichsen H, Sarrazin C, et al. Real-world experience with the all-oral, interferon-free regimen of ombitasvir/paritaprevir/ritonavir and dasabuvir for the treatment of chronic hepatitis C virus infection in the German Hepatitis C Registry. J Viral Hepat. 2017; 24(10): 840-849.
11.European Association for the Study of the Liver. EASL Recommendations on Treatment of Hepatitis C 2018. J Hepatol. 2018; 69(2): 461-511.
12.Kidney Disease: Improving Global Outcomes (KDIGO) CKD-MBD Update Work Group. KDIGO 2017 Clinical Practice Guideline Update for the Diagnosis, Evaluation, Prevention, and Treatment of Chronic Kidney Disease-Mineral and Bone Disorder (CKD-MBD). Kidney Int Suppl (2011). 2017; 7(1): 1-59.

 播放GIF
播放GIF