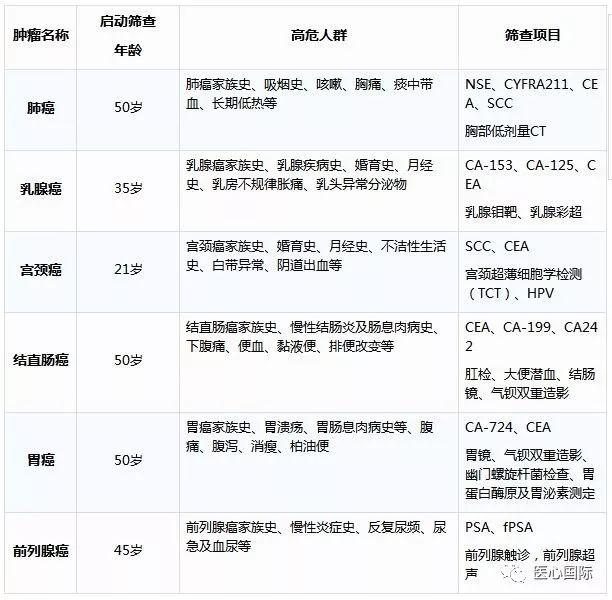
在癌症治療領域,免疫治療攜帶多項成果已經嶄露頭角,而癌症疫苗作為其中的研究熱點也初露端倪。癌症疫苗不僅有著普通疫苗的預防作用,比如宮頸癌疫苗,也能以治療性疫苗發揮著激活人體免疫系統的作用,殺傷腫瘤細胞。
癌症疫苗種類繁多,包括細胞疫苗、核酸疫苗、蛋白多肽疫苗和基因工程疫苗等。無論何種疫苗,都是將腫瘤抗原呈遞給免疫細胞,激活免疫反應,從而達到抗癌效果。今年美國臨床腫瘤學會(ASCO)上也重點收錄了一些癌症疫苗進展,我們將與大家分享!
RNA疫苗

核酸疫苗是將編碼某種抗原蛋白的外源基因(DNA 或RNA ) 直接導入動物體細胞內,並通過宿主細胞的表達系統合成抗原蛋白,誘導宿主產生對該抗原蛋白的免疫應答,以達到預防和治療疾病的目的。
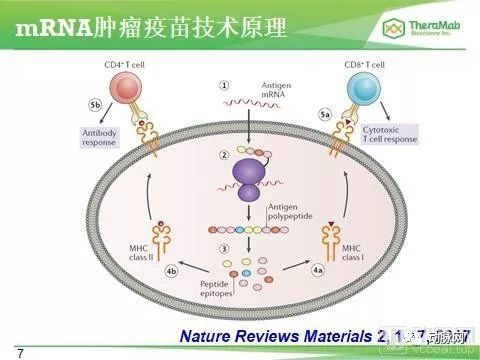
腫瘤RNA疫苗,顧名思義,則是將腫瘤抗原的RNA導入體內,產生免疫應答而達到抗癌效果。一般來說,RNA疫苗使用信使RNA(mRNA),這是翻譯成蛋白質的模板。今年ASCO上共有三項mRNA疫苗的介紹,我們將逐項講解。
第一研究關於癌症疫苗mRNA-4157單葯在可切除實體瘤以及聯合PD-1抗體K葯在不可切除實體瘤中的應用。這是一項劑量爬坡一期臨床試驗,主要終點檢測藥物的安全性、有效性和免疫原性。
mRNA-4157是一種編碼多種新抗原的脂質類個性化疫苗,用以誘導新抗原特異T細胞和相關抗癌反應。患者接受不同劑量多達9個療程的疫苗注射。
總共33名患者接受了mRNA-4157治療,其中13人為單葯,20名聯合K葯。沒有劑量限制毒性(DLT)被報導,治療相關副作用也較低且是可逆的,也沒有觀察到等級超過3的藥物相關副作用。
在13名輔助單葯治療的患者中,12名依舊保持無疾病狀態,中位隨訪期為8個月。聯合用藥的20名患者中,其中12人對前期的免疫檢測點抑製劑耐葯。最終16名患者腫瘤分期發生改變:5個藥物聯合療程內產生1個CR,2 PR,5 SD,而5 PD,2 iuPD和1個無法評估患者仍在研究中【1】。
這項研究提示我們mRNA-4157在實體瘤中的安全性和耐受性,以及聯合K葯產生的有效性,可以推進到二期臨床試驗。
第二項研究是名為ECI-006癌症疫苗在可切除黑色素瘤中的一期臨床研究。ECI-006是一混合疫苗,包括各種DC激活分子和黑色素瘤特異腫瘤相關抗原(TAA)的mRNA。研究目的為了驗證ECI-006作為輔助治療的安全性和免疫原性。
20名2c-4期手術黑色素瘤患者接受5次ECI-006注射,分別在第1天、第2、4、6和14周。最終19名患者完成治療,1名低劑量組患者由於疾病複發而終止治療。ECI-006耐受性良好,未發現超過3級嚴重副作用。
所有治療相關副作用中,肌痛 (15%)和疲勞 (25%)報導最多。根據既定標準,低劑量和高劑量組分別有4/10和3/9患者產生疫苗誘導免疫響應。ECI-006的耐受性和免疫原性也為後續與PD-1抗體聯合提供了臨床依據【2】。
最後一項研究開發了針對腫瘤細胞的新抗原,並通過抗原表位設計mRNA疫苗靶向這種新抗原,從而達到抗腫瘤的目的。新抗原對腫瘤個性化治療至關重要,研究也證明新抗原特異T細胞存在於大多數腫瘤中,是個性化疫苗的重要靶點。
該研究通過腫瘤浸潤淋巴細胞鑒定出腫瘤特異突變,並在此基礎上開發鑒定出T細胞抗原表位。這是首次在轉移上皮細胞癌中鑒定新抗原,預測新抗原表位和突變,並最終開發出名為mRNA-4650的癌症疫苗。
目前這款疫苗正在至少有一個可切除位點的轉移性黑色素瘤、胃癌和泌尿生殖癌患者中進行一期/二期臨床試驗。患者每兩周注射一次疫苗,共四個療程。主要終點是安全性、耐受性、T細胞響應以及ORR。
結果表明:mRNA-4650所有劑量均安全,沒有發現DLT和藥物相關嚴重副作用。研究觀察到響應新抗原表位的特異CD8和CD4 T細胞,但未觀察到腫瘤消退。不過,這為與免疫檢測點抑製劑和過繼T細胞治療提供了可能性【3】。
多肽疫苗

多肽疫苗是按照病原體抗原基因中已知或預測的某段抗原表位的氨基酸序列,通過化學合成技術製備的疫苗。如果能找到腫瘤細胞中特異的抗原,並以此氨基酸序列開發癌症疫苗,能夠激活相關免疫細胞殺傷具體相同抗原的腫瘤細胞。
今年ASCO有兩項關於多肽癌症疫苗的研究:第一項是多種多肽疫苗混合在侵襲性腫瘤中的應用;第二項是基於新抗原的多肽疫苗的臨床療效。
第一項研究中,侵襲性癌症患者的腫瘤和淋巴結微環境之間的研究不多,也沒有行之有效的途徑來進行調控。不過,多種多肽疫苗治療或許能解決這種問題,而且在臨床安全性上也能得到保障。
該研究總招募了11名患者,並通過各種方法確定了眾多的靶點。患者先每隔一周在淋巴結處皮下注射疫苗,共8次。然後在通過CT或PET在腫瘤活性部位皮下注射疫苗,共10次。
研究結果顯示:無論疾病進展情況如何,100%的患者對治療產生響應,其中80%達到CR,20%假性進展患者後來也發展為CR。
100%患者靶向Bcl-2 (p = 0.001), VCP (p = 0.0001), Ape-1 (p = 0.005)和RCAS1 (P = 0.0001)的Granzyme B水準得到提高,治療後掃描數據也得到相似結果。
患者在腫瘤位點(p = 0.002)比非腫瘤位點(p = 0.01)顯示出更多的CD8 T細胞浸潤。患者體內肺(p = 0.004)和肝(p = 0.001)轉移消失的數目與IL-12上升呈顯著關係。
這項研究說明在多種實體瘤的淋巴結和腫瘤位點注射多種多肽疫苗不僅安全可靠,也能提高晚期病人的臨床受益【4】。
第二項研究中,新抗原疫苗能夠激活T細胞進而殺傷腫瘤細胞。然而,大多數多肽疫苗要麼選擇HLA結合表位,要麼選擇HLA呈遞表位,都不能誘導個性化T細胞響應。該研究認為結合到多種自體HLA等位基因的個性化表位可以誘導T細胞響應。
研究人員在兩項臨床試驗中給患者注射了合成長鏈多肽(SLP)疫苗,分別鑒定出單HLA和3 HLA等位基因的抗原表位,並通過CD8和CD4 T細胞響應得以驗證。最終,他們開發出一種個性化疫苗,能結合從12種腫瘤抗原來源的14個HLA等位基因。
結果顯示:單HLA結合表位和HPV特異T細胞響應沒有相關性。相反,一類HLA個性化抗原表位與CD8 T細胞響應一致性為90% (p < 0.001),二類HLA個性化抗原表位與CD4 T細胞響應一致性為69% (p = 0.005)。
個性化抗原表位的數值可以預測SLP疫苗臨床試驗的T細胞響應率。經預測,91%和100%的多肽疫苗能分別誘導CD8和CD4 T細胞響應【5】。
DC疫苗

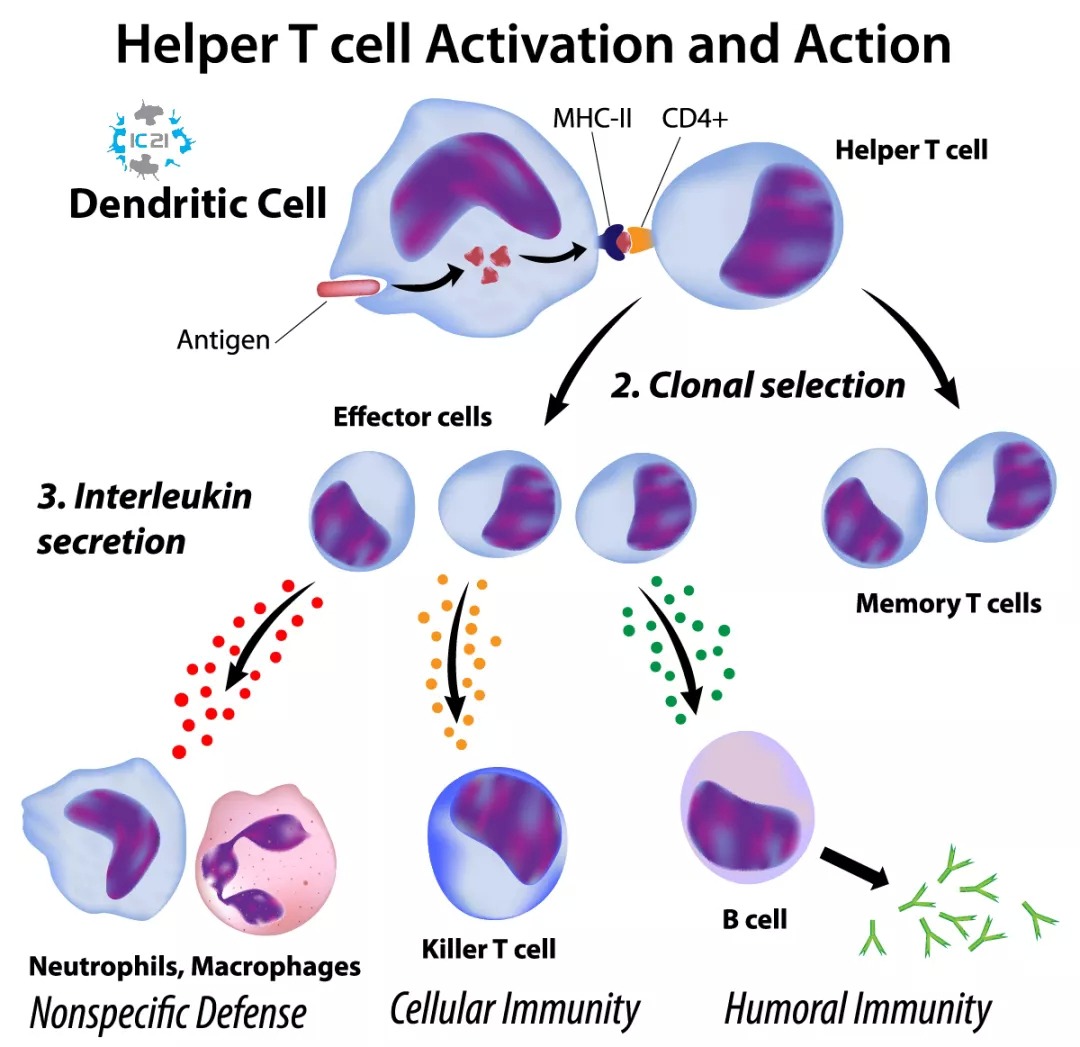
DC細胞俗稱樹突狀細胞,因成熟時伸出許多樹突樣或偽足樣突起而得名。DC是人體內抗原遞呈能力最強的細胞。這些細胞能有效識別抗原,並把抗原呈遞給免疫細胞,激活獲得性免疫系統,產生正常的免疫反應。
DC疫苗通過採用病人自體的單核細胞在體外培養誘導生成DC,然後負載相應的腫瘤抗原,製成負載腫瘤抗原的DC,再將這些DC細胞注入體內後刺激體內的腫瘤殺傷性淋巴細胞增殖,發揮長期腫瘤監視作用和腫瘤殺傷作用,達到消滅腫瘤的目的。
今年ASCO有兩項關於DC疫苗的報導。第一項是關於自體DC疫苗在轉移性黑色素瘤中的研究;第二項是靶向HER2的DC疫苗在轉移性癌症中的研究。
在第一項研究中,早期研究發現癌症患者生存深受腫瘤分期和負荷的影響。而這項研究的目的就是為了揭示黑色素瘤患者生存期與接受特異疫苗之間的關係。
所有患者具有可切除的腫瘤部分,並將其培養成腫瘤細胞系。細胞系經射線照射後,與DC一起培養產生DC疫苗。疫苗先每周注射一次,連續三周;然後每月注射一次,連續五個月。該研究收集了兩項二期臨床數據:一項單臂(NCT00948480),一項隨機(NCT00436930)。
這項數據包括45名男性和27名女性,平均年齡52歲(17-83)。腫瘤來源為37例淋巴結、20例內臟和15例軟組織。所有存活患者經歷了5年隨訪,只有輕微細胞毒性。所有72位患者的中位OS為49.4個月,5年OS為46%。
生存期與起始三次注射的DC和照射腫瘤細胞的數量沒有相關性。複發3期患者(n=18) 5年OS為72%,不可測量4期患者(n=30) 5年OS為53%。可測量4期患者(n=18)經歷了平均4次前治療,他們中位OS為18.5個月,2年OS為46%【6】。
在第二項研究中,研究者開發出靶向HER2的自體DC疫苗,通過腺病毒轉導。在動物實驗中,這種疫苗治癒了所有腫瘤移植小鼠。這項研究將這些發現轉化為臨床試驗。
這是一項開放的一期臨床試驗,招募患者標準有兩條:一是經過至少一次標準治療後進展的轉移性腫瘤患者;二是HER2免疫組化水準較高的高風險膀胱癌患者。
第一部分患者中,最低劑量疫苗(5ⅹ106細胞,N=7,2人未能評估)並無臨床受益。在第二和第三劑量水準(107和2ⅹ107細胞,N=7和N=4,分別有0和1人未能評估),觀察到1個CR(卵巢癌),1個PR(胃癌)和3個SD(1個卵巢癌和2個結腸癌)。
兩名接受疫苗作為輔助治療的患者在超過24和36個月沒有複發。第二部分患者中(N=6,2人未能評估),1男性乳腺癌患者顯示SD。研究發現兩年隨訪未發現心臟毒性。下表是響應評估數據【7】。

基因工程疫苗

基因工程疫苗是將病原的保護性抗原編碼的基因片段克隆入表達載體,用以轉染細胞或真核細胞微生物及原核細胞微生物後得到的產物。或者將病原的毒力相關基因刪除掉, 使成為不帶毒力相關基因的基因缺失疫苗。
今年ASCO報導了兩項基因工程疫苗的研究。第一項關於沙粒病毒淋巴細胞性脈絡叢腦膜炎病毒(LCMV)疫苗在HPV16驅動的癌症中的研究;第二項關於沙粒病毒載體平台促進CD8 T細胞免疫相關研究。
在第一項研究中,癌症的有效免疫需要誘導腫瘤特異CD8 T細胞(CTL)響應,這種響應可以持續反覆激活。Hookipa醫藥公司基於LCMV工程化了一個病毒載體平台(TheraT)。這項研究提供了其中一種先導產品HB-201在HPV16驅動癌症中的臨床前數據。
TheraT-E7E6編碼了高度免疫原性但非致癌的HPV16癌蛋白E7和E6。TheraT-E7E6的安全性通過兩種方式體現:一是載體系統給葯後的快速清除,二是在小鼠體內降低神經毒性。TheraT-E7E6可以皮下注射作為系統治療,也能瘤內注射作為局部治療。
治療結果顯示疫苗誘導出大量的CD8 T細胞增殖和高頻E7和E6特異CTL響應,伴隨均衡的效應/中心記憶T細胞群體。這些響應在繼續注射TheraT-E7E6會進一步提升和激活。
TheraT-E7E6顯著降低了同系小鼠TC-1腫瘤模型的腫瘤負荷,這是一種HPV驅動的模型。即使在高腫瘤負荷(~300mm3)小鼠中,TheraT-E7E6也能顯著控制腫瘤生長和提高生存率,具有高頻的E7特異CTL能維持數周之久。
TheraT治療後腫瘤根除的動物可維持長效免受腫瘤再攻擊。另外,TheraT在免疫檢測點抑製劑複發模型中也顯示出有效性,並且能夠與這些抑製劑聯合達到協同作用【8】。
在第二項研究中,誘導出對TAA強力CD8 T細胞免疫是腫瘤治療中關鍵且充滿挑戰的目標。這項研究通過開發基於沙粒病毒遞送平台來應對這項挑戰。
此前研究顯示:基因工程化LCMV載體TheraT雖然能夠誘導TAA特異CD8 T細胞免疫,但重新注射這些載體並不能提升持續響應。因此,研究者工程化以及特化了基於不同沙粒病毒的遞送平台。
結果顯示:異源TheraT(CAND) – TheraT(LCMV)和TheraT(PIC)-TheraT(LCMV)能通過增加免疫顯性而持續提升TAA特異CD8 T細胞響應。
相應地,小鼠尾靜脈注射疫苗促發50% TAA抗原表位特異CD8 T細胞響應,並治癒了移植腫瘤。相反,TheraT(MOP) – TheraT(LCMV)由於T細胞抗原表位交叉反應而具有較差免疫原性,不能有效激活T細胞免疫【9】。
小結
疫苗的誕生使人類擺脫了眾多傳染性疾病的困擾,而接種疫苗也成為每個人不可或缺的經歷。癌症疫苗的概念不僅可以使我們對疾病防患於未然,也能激活人體的免疫系統來戰勝癌症。但由於癌症本身是一種複雜的疾病,顯著還沒有一種疫苗能抵抗所有癌症。
ASCO的研究使我們認識到,不同癌症不同患者存在著不同的抗原,只有找出這些特異的抗原,針對性地開發出相關疫苗,才能有的放矢的激活患者免疫系統,抑製腫瘤細胞的生長。癌症疫苗聯合其他療法有可能更好地發揮效應,使患者更大程度地獲益!
參考文獻:
【1】Howard A. Burris, Manish R. Patel, Daniel C. Cho, Jeffrey Melson Clarke, Martin Gutierrez, Tal Z. Zaks, Joshua Frederick, Kristen Hopson, Kinjal Mody, Alverina Binanti-Berube, Celine Robert-Tissot, Bree Goldstein, Ben Breton, Jing Sun, Shan Zhong, Scott K. Pruitt, Karen Keating, Robert S. Meehan, Justin F. Gainor. A phase I multicenter study to assess the safety, tolerability, and immunogenicity of mRNA-4157 alone in patients with resected solid tumors and in combination with pembrolizumab in patients with unresectable solid tumors. J Clin Oncol 37, 2019 (suppl; abstr 2523).
【2】ANA Maria Arance Fernandez, Jean-Francois Baurain, Christof Vulsteke, Annemie Rutten, Ainara Soria, Javier Carrasco, Bart Neyns, Brenda De Keersmaecker, Tim Van Assche, Bertil Lindmark. A phase I study (E011-MEL) of a TriMix-based mRNA immunotherapy (ECI-006) in resected melanoma patients: Analysis of safety and immunogenicity. J Clin Oncol 37, 2019 (suppl; abstr 2641).
【3】Gal Cafri, Jared J. Gartner, Kristen Hopson, Robert S. Meehan, Tal Z. Zaks, Paul Robbins, Steven A. Rosenberg. Immunogenicity and tolerability of personalized mRNA vaccine mRNA-4650 encoding defined neoantigens expressed by the autologous cancer. J Clin Oncol 37, 2019 (suppl; abstr 2643).
【4】Juan Pablo Marquez-Manriquez, Pedro Alejandro Lucero-Diaz, Jose Antonio Matute-Briseno, Alejandro Camacho-Hernandez, Dolores Gallardo-Rincon. Effect of subcutaneous multipeptide active antigen-specific immunotherapy at lymph nodes and tumor sites on clinical outcomes in progressive tumors. J Clin Oncol 37, 2019 (suppl; abstr 2636).
【5】Eniko Rita Toke, Mónika Megyesi, Levente Molnar, József Tóth, Orsolya L?rincz, Sjoerd H. van der Burg, Marij Welters, Cornelis Joseph Melief, Wolfgang Sch?nharting, Sybille Urban, Tim Roehnisch, Uwe Heine, Eszter Somogyi, Zsolt Csiszovszki, Katalin Pántya, Péter Páles, István Miklós, Franco Lori, Julianna Lisziewicz. Prediction the clinical outcomes of cancer patients after peptide vaccination. J Clin Oncol 37, 2019 (suppl; abstr e14295).
【6】Robert O. Dillman, Andrew N Cornforth, Edward Francis McClay, Carol DePriest. Survival by stage and tumor measurability in metastatic melanoma patients treated with autologous dendritic cell tumor cell vaccines. J Clin Oncol 37, 2019 (suppl; abstr 2637).
【7】Hoyoung M. Maeng, Lauren Virgi年 Wood, Brittni Moore, Mohammadhadi H. Bagheri, Santhana Webb, Lee England, Giselle Martinez, Seth M. Steinberg, Svetlana Pack, David Stroncek, John Charles Morris, Masaki Terabe, Jay A. Berzofsky. Preliminary results of a phase I clinical trial using an autologous dendritic cell cancer vaccine targeting HER2 in patients with metastatic cancer or operated high-risk bladder cancer (NCT01730118). J Clin Oncol 37, 2019 (suppl; abstr 2639).
【8】Sarah Schmidt, Weldy V. Bonilla, Mindaugas Pauzuolis, Andrea Reiter, Theresa Kleissner, Daniel Oeler, Felix Stemeseder, Ursula Berka, Bettina Kiefmann, Sophie Schulha, Igor Matushansky, Doron Merkler, Daniel Pinschewer, Klaus Karl Orlinger. Live-attenuated LCMV-based vector for active immunotherapy of HPV16+ cancer. J Clin Oncol 37, 2019 (suppl; abstr e14303).
【9】Klaus Karl Orlinger, Weldy V. Bonilla, Sandra M Kallert, Nicole Kirchhammer, Anna-Friederike Marx, Magdalena Krzyza年k, Sarah Schmidt, Josipa Raguz, Ursula Berka, Stephan Guenther, Alfred Zippelius, Daniel Pinschewer. Arenavirus-based vector platform for massive tumor self-antigen-specific CD8 T cell immunity. J Clin Oncol 37, 2019 (suppl; abstr e14297).


閱讀原文,獲取